Слайд 2Раствор – гомогенная система, переменного химического состава, состоящая из двух и более компонентов: растворитель и растворенное вещество (вещества).
Классификация растворов
по агрегатному состоянию: газовые(воздух), жидкие(морская вода), твердые (сплавы) по составу растворителя (водные, аммиачные, бензольные и др.)
Слайд 3П
По размеру частиц или по степени измельченности (дисперстности): Взвеси (грубодисперстные системы) - размер частиц 10-3 -10-5 см. Взвеси - очень непрочные, гетерогенные системы. Грубодисперсные системы обычно бывают в виде суспензий, эмульсий, аэрозолей. Приведите примеры природных грубодисперсных систем?
Слайд 4Коллоидные растворы - размер частиц 10-5 - 10-7 см. Примером коллоидных ДС служат растворы клея и желатины. Коллоидные растворы отличаются тем, что их частицы сильно рассеивают проходящий через них свет и делают заметным путь пропущенного светового луча (эффект Тиндаля). Истинные растворы – размер частиц 10-7 - 10-8 см, это гомогенные, устойчивые ДС.
Слайд 5по отношению к равновесию (растворимое вещество – раствор) ( насыщенный, ненасыщенный, перенасыщенный) Насыщенный раствор – находится в равновесии с твердым не растворившемся веществом, т.е. скорость растворения равна скорости его кристаллизации. Концентрация насыщенного раствора наз. растворимостью с указанием температуры, при которой она определена.
Слайд 6Растворимость - число моль растворенного в-ва в одном литре раств-ля (в состоянии насыщения) Коэфф. растворимости - масса раств-го компонента в 100 г. раств-ля Ненасыщенный раствор - содержит раств-го в-ва меньше равновесного кол-ва, т.е. скорость растворения больше скорость кристаллизации. Перенасыщенный раствор - скорость кристаллизации больше скорость растворения.
Si = ni V [моль/л]
Слайд 7Растворимость некоторых веществ при различных температурах
S T
Слайд 8Способы выражения концентрации растворов
Слайд 9Массовая доля () - отношение массы раств-го в-ва к общей массе раствора: =
m2 m1 +m2 [%]
Слайд 102) Мольная доля (N) - отношение числа моль раств-го в-ва к общему числу моль всех в-в, образующих раствор:
Слайд 113) Моляльность(Сm) - отношение числа моль растворенного вещества к массе растворителя:
;[моль/кг]
Слайд 12Молярная концентрация вещества (См) – отношение числа моль растворенного вещества к объему раствора
;[моль/л]
Слайд 132)Молярная конц-ция эквивалентов в-ва (Сэ) – кол-тво (моль) эквивалентов растворенного вещества в 1 л раствора.
Сэ = m1 Mэ•V
Слайд 143) Титр (Т) - масса (г) растворенного вещества в 1 мл р-ра
;[г/мл ]
Слайд 15Химическая теория растворов
Физико-химическая теория растворов разработана Д.И. Менделеевым, И.А. Каблуковым, В.А. Кистяковским и др. Основной принцип теории: между компонентами р-ров образуются хим. соединения определенного состава - сольваты (гидраты)
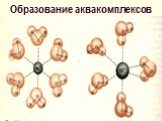
Слайд 16Между частицами внутри сольватов существует сильное взаимодействие и часто они образуют комплексы, в которых осуществляется донорно-акцепторное взаимодействие [Cu(H2O)6]Cl2 [Fe(H2O)6]Cl3 [Be(H2O)4]Cl2
Слайд 17Механизм растворения
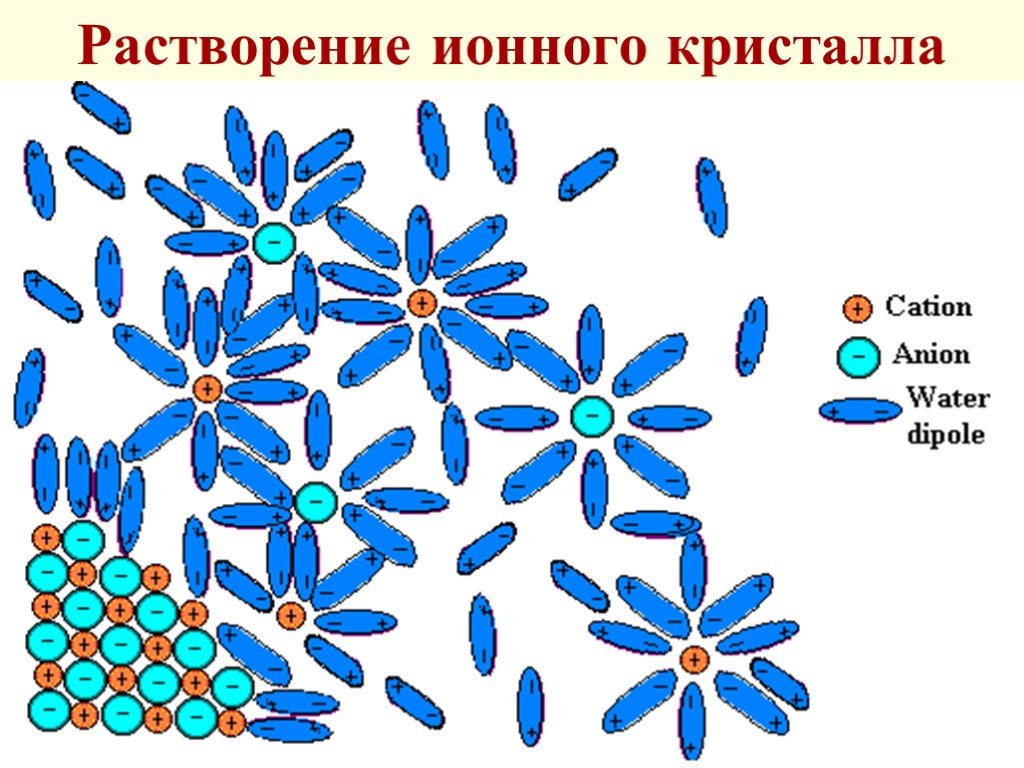
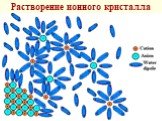
твердого вещества в жидкости состоит в том, что молекулы растворителя образуют с поверхностными молекулами (атомами, ионами) химические связи, при этом ослабляются связи этих молекул внутри твердого вещества
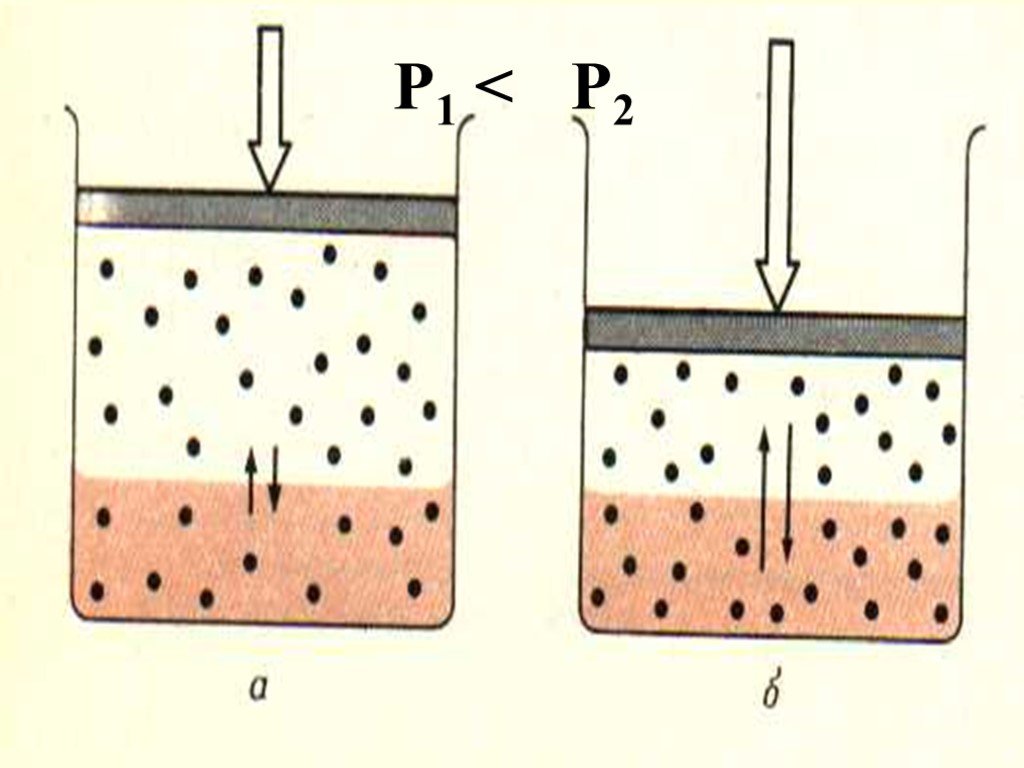
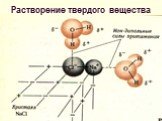
Слайд 18Растворение твердого вещества
Слайд 19В итоге образовавшийся комплекс отрывается и диффундирует в р-р Этот процесс обратим и с увеличением концентрации в-ва скорость обратного процесса (кристаллизации) становится все больше, сравниваясь со скоростью растворения
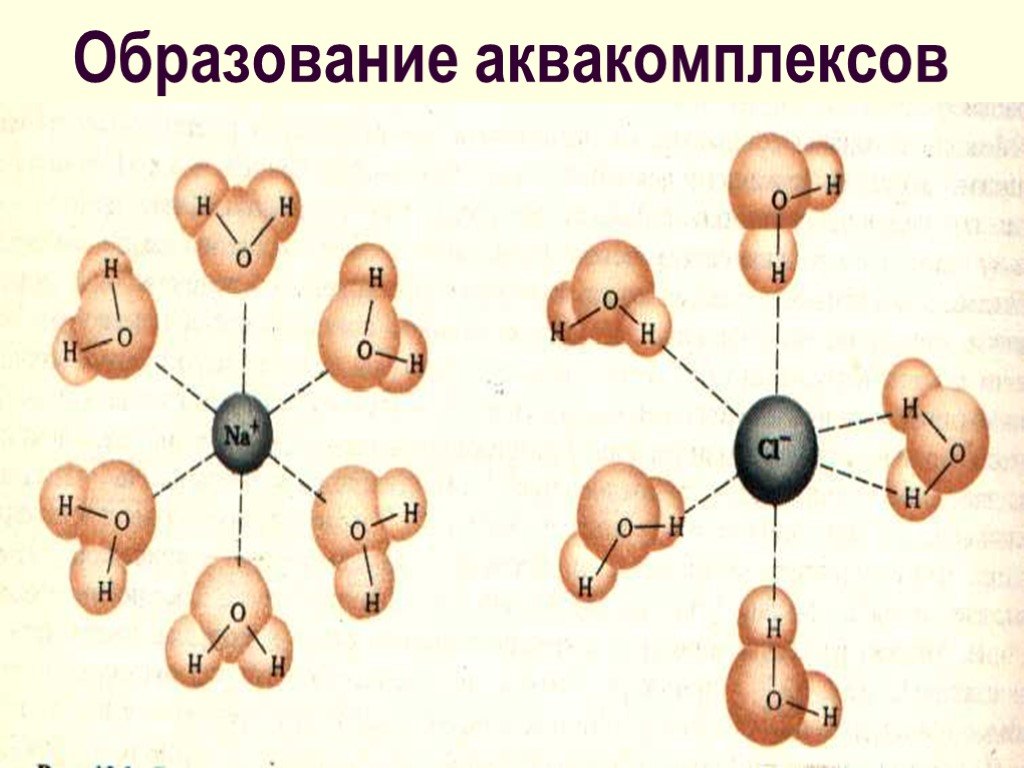
Слайд 20Образование аквакомплексов
Слайд 21Влияние природы вещества на растворимость
Растворение - это химическое взаимодействие, которое проявляется в изменении объема раствора и тепловом эффекте
Слайд 22Если тип межмолекулярных связей в компонентах р-ра и между ними одинаков, то возможны любые соотношения между компонентами р-ра
Подобное растворяется в подобном
Слайд 23Примеры: бесконечная растворимость спирта в воде (водородные связи) орг. в-в в орг-ких жидкостях (ван-дер-ваальсовы силы) ограниченная раств-сть солей (ионная связь) в воде (водородная связь)
Слайд 24Раств-сть полярных в-в опр-ся природой раств-ля. Большое значение имеет его диэл-кая проницаемость () : чем она больше, тем легче диссоциация на ионы, т.к. По этой причине многие соли лучше растворяются в воде ( = 80), чем в спирте ( = 25)
Слайд 25Термодинамика растворения
При растворении происходит три процесса: 1) перехода компонентов из индивидуального состояния в раствор (фазовый переход); 2) гидратация; 3) диффузия Энтальпия растворения равна сумме энтальпий этих процессов: ΔНр-ния = ΔНф.п + ΔНгидр
Слайд 26Экзотермическое растворение - при растворении газа или жидкости энтальпия фазового перехода меньше энтальпии гидратации и растворение сопровождается выделением тепла. Эндотермическое растворение – при растворении кристаллических веществ требуется значительная энергия (энергия кристаллической решетки) на их разрушение, которая больше энтальпии гидратации, и в этом случае процесс растворения сопровождается поглощением тепла.
Слайд 27При растворении газов энтропия уменьшается. При растворении твердых веществ увеличивается. Растворение жидкостей сопровождается также увеличением энтропии. Образование раствора происходит самопроизвольно, энергия Гиббса процесса растворения отрицательна: ΔGр-ния = ΔНр-ния – Т·ΔSр-ния < 0
Слайд 28Взаимное влияние на растворимость
Слайд 29При условии ΔGр-ния
Слайд 30Растворимость газов
в жидкостях и тв. телах идет без разрушения крист. решетки теплота растворения определяется теплотой гидратации, которая всегда Н 0 (при нагревании растворимость ум-ся) уменьшается объем газа при его поглощении (V 0), что соответствует S 0 это приводит к уменьшению растворимости с ув-ем температуры
Слайд 31Закон Генри Растворимость газа в жидкостях (и в твердых веществах) при постоянной температуре пропорциональна его давлению: Si = K•Pi Для смеси газов их раств-сти пропорциональны парциальным давлениям
Слайд 33Свойства разбавленных растворов неэлектролитов
Р-ры неэлектролитов по свойствам приближаются к идеальным газам Их свойства пропорциональны конц-циям компонентов, они аддитивны (обусловлены коллективом частиц), поэтому их называют коллигативными св-вами
Слайд 34Коллигативные свойства давление пара раств-ля над раствором температура кипения температура замерзания осмотическое давление
Слайд 35I закон Рауля
Обозначения: Растворенное вещество - нелетучее Р1 давление пара растворителя над раствором P10 - давление пара над чистым растворителем N1 и N2 мольные доли растворителя и раств-го в-ва
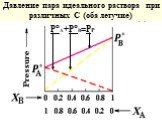
Слайд 36Давление пара идеального раствора при различных С (оба летучие)
Р°А+Р°В=РР
Слайд 37Если одно из веществ нелетучее Для чистого растворителя: N1 = 1 ; P1 = P10 = K Для р-ра : P1 = P10 . N1 т. к. N1 = 1 - N2 , то P1 = P10 (1 - N2 ) P1 - P10 = P10 N2 Р = P10 N2 Понижение давления насыщ.пара растворителя над раствором пропорционально мольной доле раствор-го в-ва
Слайд 38II закон Рауля
Повышение температуры кипения и понижение температуры замерзания р-ров пропорциональны моляльной концентрации растворенного вещества Tk = E•Cm Е - эбулиоскопическая константа; Сm - моляльная концентрация, моль/кг Tз = K•Cm К - криоскопическая константа
Слайд 39Закон Вант-Гоффа
Осмос - явление односторонней диффузии через полупроницаемую перегородку Осмотическое давление равно тому давлению, которое имело бы раств-ное вещество, будучи в газообразном состоянии в объеме раствора
Слайд 40Растворы имеющие одинаковые осмотические давления наз изотоническими. Гипертонический раствор – имеет большее осмотическое давление, чем раствор сравнения. Гипотонический р-р - имеет меньшее осмотическое давление, чем раствор сравнения.
Слайд 41Растворы электролитов
Слайд 42Теория электролитической диссоциации (С. Аррениус 1887 г.)
объясняет отклонения ряда растворов от законов Рауля и Вант-Гоффа Эти растворы обладали электропроводностью большей, чем чистый растворитель
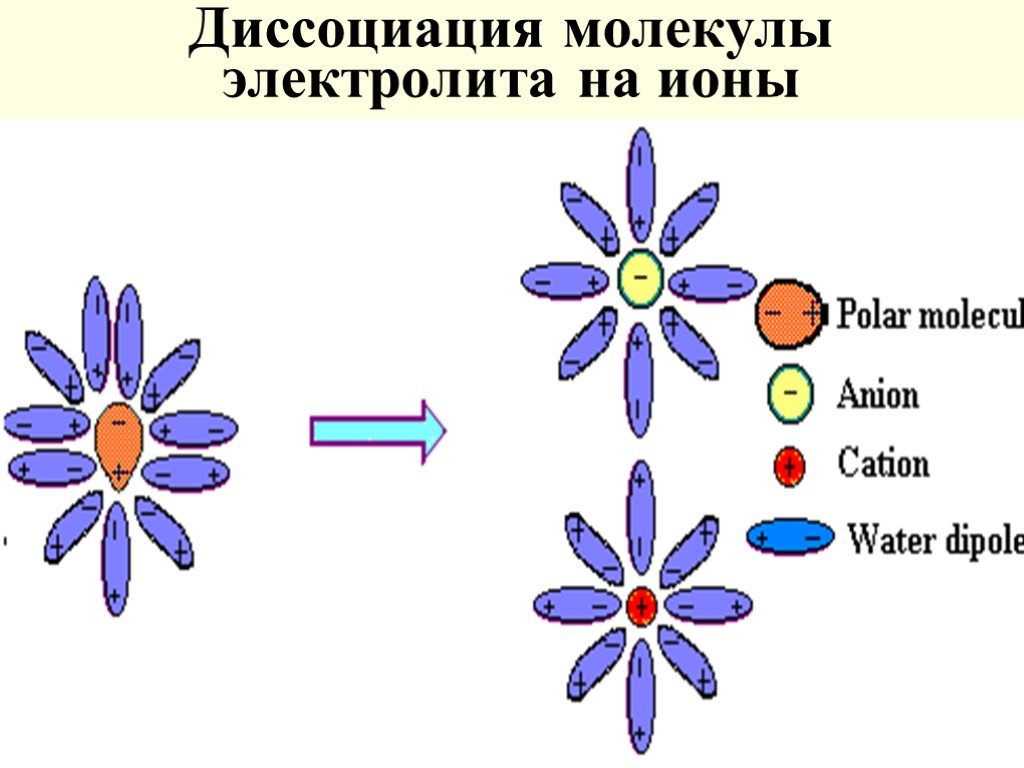
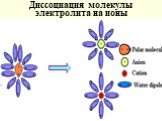
Слайд 43Основные положения: Растворяясь, в-во диссоц-ет на ионы Ионы в р-ре гидратируются (сольватируются) Сильно разб-е р-ры электролитов приближаются к идеальным с учетом числа частиц образующихся в растворе
Слайд 44Конц. р-ры отклоняются от свойств идеальных р-ров из-за сильного взаимодействия противоионов, которые образуют сложные частицы, что уменьшает их количество
Слайд 45Растворение ионного кристалла
Слайд 46Диссоциация молекулы электролита на ионы
Слайд 47Характеристики растворов электролитов
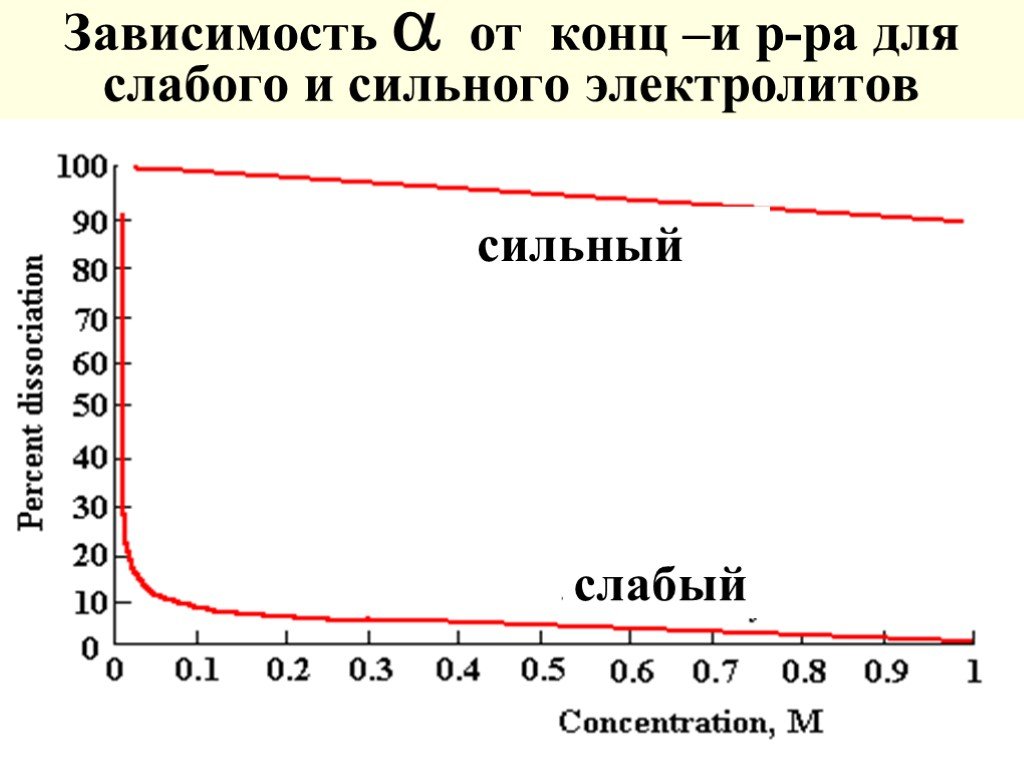
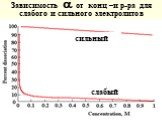
Степень диссоциации электролитов () - отношение числа распавшихся молекул к общему числу растворенных и зависит от концентрации раствора [ доля от 1 или %] - электропр-ость при разбавлении Электролиты делят на слабые (0,3)
Слайд 48Зависимость от конц –и р-ра для слабого и сильного электролитов
сильный слабый
Слайд 49Константа диссоциации
Это константа равновесия электрол-кой диссоциации KnAm nKm+ + mAn- С СК СА слабые электролиты - КД10-2
Слайд 50Для слабых электролитов (1-) 1 и однозарядных ионов (n = m = 1)
Закон разбавления Оствальда
Слайд 51Изотонический коэффициент (i)
- отношение общего числа частиц в р-ре к числу раств-ных молекул В р-рах электролитов реально существующее число частиц > числа растворенных молекул Поэтому вводится поправочный коэффициент (i), учитывающий изменение числа частиц: i =
nреал nобщ
Слайд 53Кажущаяся степень диссоциации
KnAm nKm+ + mAn- - кажущаяся степень диссоциации сильных электролитов ( ;
Слайд 54Обменные реакции в растворах электролитов
Диссоциация многоосновных кислот и многокислотных оснований идет ступенчато H3PO4 = H2PO4– + H+ К1 = 7,410 –3 H2PO4– = НPO42– + H+ К2 = 6,310–8 НPO42– = PO43– + H+ К3 = 4,410–13
Слайд 55Растворимые средние соли (Na2CO3, NaCl, K2SO4 и др.) - обычно сильные электролиты и диссоц-ют в воде нацело Кислые соли диссоциируют на катион металла и гидроанион: NaHCO3 = Na+ + HCO3– Основные соли - на гидроксокатион и анион: MgOHCl = MgOH+ + Cl–
Слайд 56Правило Бертолле
Равновесие в ионных реакциях смещено в сторону образования нерастворимых соед-ний, газов и слабых электролитов К1А1 + К2А2 = К1А2 + К2А1 К1А1 = К1+ + А1-
Слайд 57а) Кр > 1 ; К11• К22 > К12 • К21 б) Кр < 1 ; К11• К22 < К12 • К21 в) Кр реакция необратима
Слайд 58Ионное произведение воды
Вода - слабый электролит Н2О = Н+ + ОН– Ионное произведение воды: Kд.[H2O] = 1,86.10–16.55,5 = = [H+].[OH–] = 10–14 = Кw Кw не зависит от конций ионов
Слайд 59Водородный показатель
Кислотность или основность водных растворов характеризуется конц-ей [Н+] или [ОН–] ионов Удобнее использовать логарифмическое выражение: рН = -lg [H+] и pOH = -lg [OH–] Для воды [Н+] = [ОН–] = 10–7 рН = рОН = 7 - нейтральная среда
Слайд 60Если в растворе: [Н+] > [ОН–], то рН < 7, а рОН > 7 – это кислые растворы [Н+] < [ОН–], то рН > 7, а рОН < 7 – это щелочные р-ры pН + pOH = 14
Слайд 61Произведение растворимости
Для трудно растворимых соед-ний Ag2СO3 (тв) 2Ag+ р + CO32- р ПРAg2CO3 – произведение растворимости
Слайд 62Ув-ие или ум-ие одной из концентраций ионов приведет к изменению другой ПР связано с раств-стью (S) Для электролита, имеющего катион и анион равного заряда вытекает: ПР = S2 или
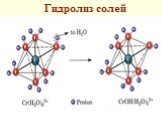
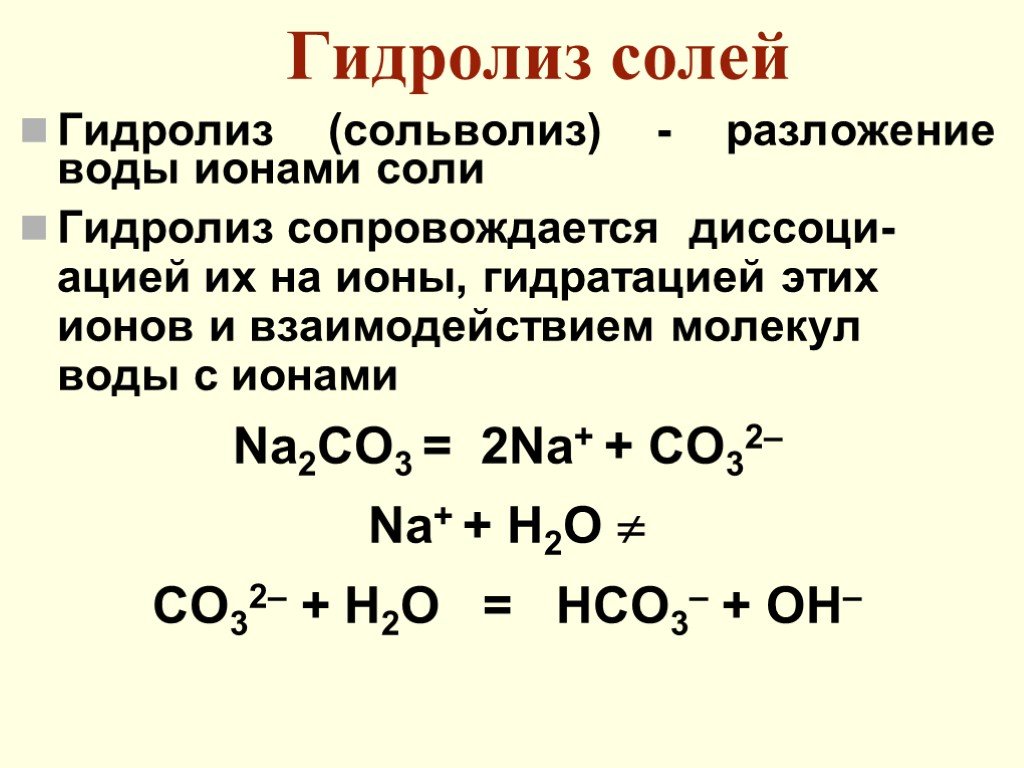
Слайд 63Гидролиз солей
Гидролиз (сольволиз) - разложение воды ионами соли Гидролиз сопровождается диссоци-ацией их на ионы, гидратацией этих ионов и взаимодействием молекул воды с ионами Na2CO3 = 2Na+ + CO32– Na+ + H2O CO32– + H2O = HCO3– + OH–
Слайд 64
Слайд 65Закономерности гидролиза
При гидролизе (сольволизе) идет разрыв ков-ной полярной связи в молекуле раств-ля и образование новой связи с ионом соли Гидролиз тем легче, чем > степень ионности связи в раств-ле и < между молекулой раств-ля и ионом соли Чем > поляризация, тем < ионность и > ковалентность и тем полнее идет гидролиз (сольволиз)
Слайд 66Сильному гидролизу подвергаются: — катионы с сильно поляризующей способностью (Al3+, Fe3+, Bi3+) — анионы с сильной поляризуемостью (CO32–, SO32–, NO2–, CN–, S2– и др.) Не гидролизуются: — слабо поляризующие катионы I и II группы (Na+, Ca2+и др.) — слабо поляризуемые анионы (Hal– , NO3–, SO42–, MnO4–, ClO4–, Cr2O72–)
Слайд 67Сильно поляризующие катионы образуют слабые основания сильно поляризуемые анионы образуют слабые кислоты Закономерности гидролиза р-ров солей: — гидролизуются катионы слабых оснований и анионы слабых кислот; Al3+ + H2O = Al(OH)2+ + H+ SO32– + H2O = HSO32– + OH– — не гидролизуются анионы сильных кислот и катионы сильных оснований
Слайд 68Количественные характеристики гидролиза
h - степень гидролиза (доля гидролизованных частиц) Кh - константа гидролиза Пример: А– + Н2О = НА + ОН–
h = nгидр nобщ
Слайд 69Гидролиз соли по катиону: Гидролиз соли по соли по катиону и аниону:















































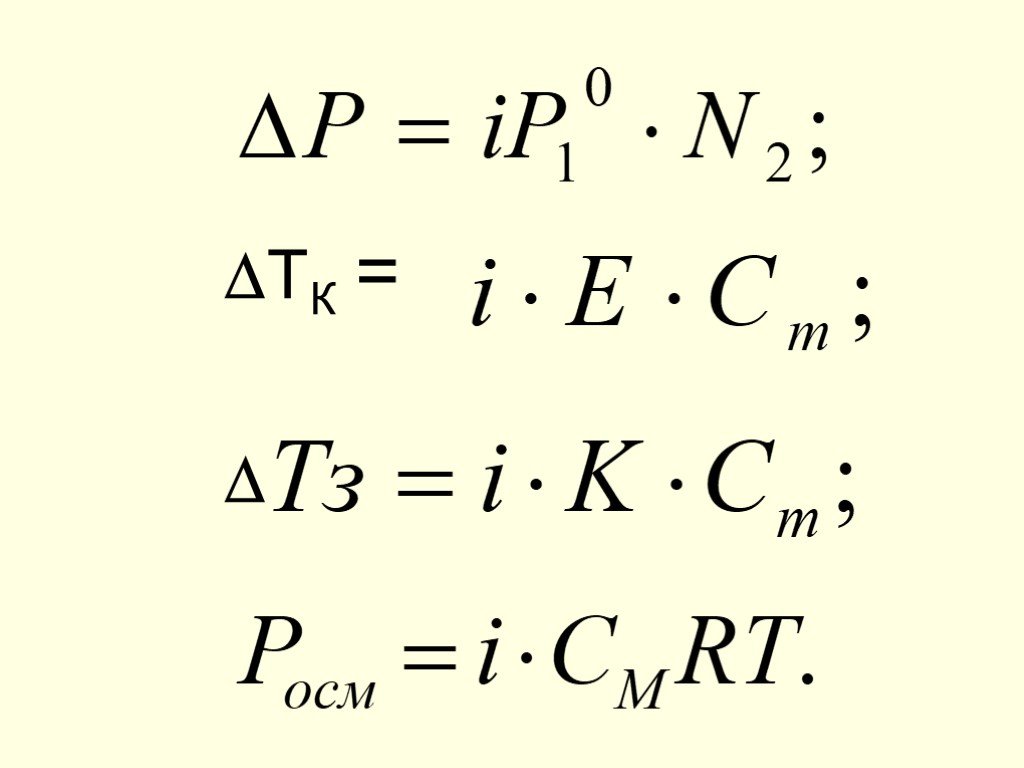























![Массовая доля () - отношение массы раств-го в-ва к общей массе раствора: =. m2 m1 +m2 [%] Массовая доля () - отношение массы раств-го в-ва к общей массе раствора: =. m2 m1 +m2 [%]](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen9.jpg)
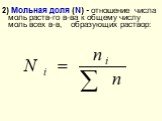
![3) Моляльность(Сm) - отношение числа моль растворенного вещества к массе растворителя: ;[моль/кг] 3) Моляльность(Сm) - отношение числа моль растворенного вещества к массе растворителя: ;[моль/кг]](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen11.jpg)
![Молярная концентрация вещества (См) – отношение числа моль растворенного вещества к объему раствора. ;[моль/л] Молярная концентрация вещества (См) – отношение числа моль растворенного вещества к объему раствора. ;[моль/л]](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen12.jpg)

![3) Титр (Т) - масса (г) растворенного вещества в 1 мл р-ра. ;[г/мл ] 3) Титр (Т) - масса (г) растворенного вещества в 1 мл р-ра. ;[г/мл ]](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen14.jpg)

![Между частицами внутри сольватов существует сильное взаимодействие и часто они образуют комплексы, в которых осуществляется донорно-акцепторное взаимодействие [Cu(H2O)6]Cl2 [Fe(H2O)6]Cl3 [Be(H2O)4]Cl2 Между частицами внутри сольватов существует сильное взаимодействие и часто они образуют комплексы, в которых осуществляется донорно-акцепторное взаимодействие [Cu(H2O)6]Cl2 [Fe(H2O)6]Cl3 [Be(H2O)4]Cl2](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen16.jpg)
























![Характеристики растворов электролитов. Степень диссоциации электролитов () - отношение числа распавшихся молекул к общему числу растворенных и зависит от концентрации раствора [ доля от 1 или %] - электропр-ость при разбавлении Электролиты делят на слабые (0,3) Характеристики растворов электролитов. Степень диссоциации электролитов () - отношение числа распавшихся молекул к общему числу растворенных и зависит от концентрации раствора [ доля от 1 или %] - электропр-ость при разбавлении Электролиты делят на слабые (0,3)](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen47.jpg)



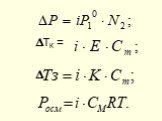





![Ионное произведение воды. Вода - слабый электролит Н2О = Н+ + ОН– Ионное произведение воды: Kд.[H2O] = 1,86.10–16.55,5 = = [H+].[OH–] = 10–14 = Кw Кw не зависит от конций ионов Ионное произведение воды. Вода - слабый электролит Н2О = Н+ + ОН– Ионное произведение воды: Kд.[H2O] = 1,86.10–16.55,5 = = [H+].[OH–] = 10–14 = Кw Кw не зависит от конций ионов](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen58.jpg)
![Водородный показатель. Кислотность или основность водных растворов характеризуется конц-ей [Н+] или [ОН–] ионов Удобнее использовать логарифмическое выражение: рН = -lg [H+] и pOH = -lg [OH–] Для воды [Н+] = [ОН–] = 10–7 рН = рОН = 7 - нейтральная среда Водородный показатель. Кислотность или основность водных растворов характеризуется конц-ей [Н+] или [ОН–] ионов Удобнее использовать логарифмическое выражение: рН = -lg [H+] и pOH = -lg [OH–] Для воды [Н+] = [ОН–] = 10–7 рН = рОН = 7 - нейтральная среда](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen59.jpg)
![Если в растворе: [Н+] > [ОН–], то рН < 7, а рОН > 7 – это кислые растворы [Н+] < [ОН–], то рН > 7, а рОН < 7 – это щелочные р-ры pН + pOH = 14 Если в растворе: [Н+] > [ОН–], то рН < 7, а рОН > 7 – это кислые растворы [Н+] < [ОН–], то рН > 7, а рОН < 7 – это щелочные р-ры pН + pOH = 14](https://prezentacii.org/upload/cloud/18/09/75582/images/thumbs/screen60.jpg)