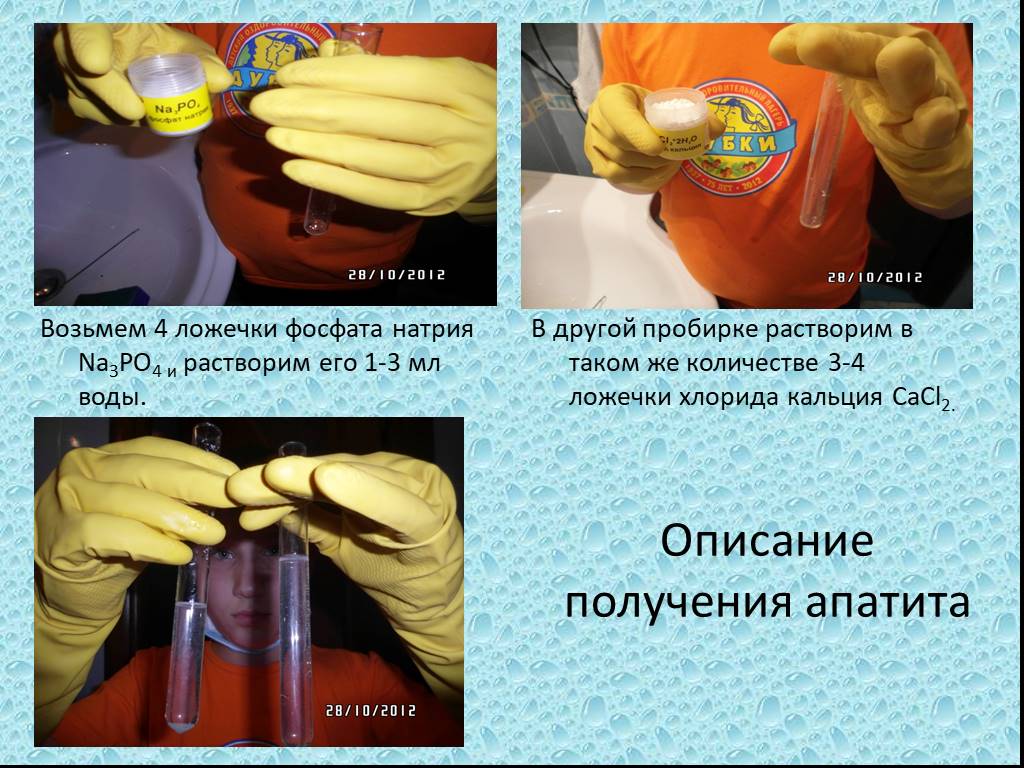
Презентация "Описание получения апатита" по химии – проект, доклад
Презентацию на тему "Описание получения апатита" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 9 слайд(ов).
Слайды презентации
Список похожих презентаций
Современные углеродные наноматериалы: технологии получения и применения в промышленности
Институт тепло-и массообмена Национальной академии наук Беларуси: www.itmo.by. Институт тепло-и массообмена Национальной академии наук Беларуси. Основные ...Способы получения металлов
Электрометаллургический способ. Электрометаллургия методы получения металлов, основанные на выделении металлов из растворов или расплавов их соединений ...Нитрозный способ получения серной кислоты
Реагенты. Медь Азотная кислота Сульфит натрия Раствор серной кислоты 70%. Приборы. Две колбы Вюрца Трехгорлая колба 2 газоотводных шланга Штативы ...Основания. Химические свойства. Способы получения
Химические свойства. Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы. ...Натрий.Способы получения
Электролиз расплава хлорида натрия (поваренной соли) 2NaCl → 2Na + Cl₂ Для получения расплава кристаллы хлорида натрия необходимо нагреть до 500 – ...Методы получения МОКС топлива
МОКС-топливо (MOX-топливо) – это ядерное топливо, состоящее из смеси диоксидов урана и плутония. Причины использования: 1) сжигание избыточного плутония; ...Металлы в природе. Общие способы их получения
Распространенность металлов в природе. Содержание некоторых металлов в земной коре: Алюминий 8,2% Железо 5,0% Кальций 4,1% Натрий 2,3% Магний 2,3% ...Способы получения металлов
Металлургия. Металлургия – наука о промышленных способах получения металлов из природного сырья. Металлургия делится на три отрасли: пирометаллургию, ...Древесное сырье для получения коптильного дыма
Для приготовления коптильного дыма используют различное измельченное древесное сырье (в виде опилок, щепы и т.д.), которое подвергают пиролизу в дымогенераторах ...Алкины-способы получения и химические свойства
Тема и цели урока:. Тема: «Ацетилен. Алкины». Цель урока: Дать представления об углеводородах с тройной связью. О их физико-химических свойствах и ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов. Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...Коллоидная химия
Признаки объектов коллоидной химии. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Конспекты
Строение, способы получения и свойства алканов
Тема урока: Строение, способы получения и свойства алканов. . . Цель урока:. Изучить. . способы получения, физические и химические свойства, ...Способы получения металлов
Разработка урока для учащихся 10 класса. Тема урока. «Способы получения металлов». Цель урока:. . Рассмотреть запасы природных соединений металлов ...Понятие о металлургии. Способы получения металлов. Сплавы (сталь, чугун, дюралюминий, бронза). Проблема безотходных производств в металлургии и охрана окружающей среды
Дата_____________ Класс_______________. Тема:. Понятие о металлургии. Способы получения металлов. Сплавы (сталь, чугун, дюралюминий, бронза). Проблема ...Общие способы получения металлов
Тема:. "Общие способы получения металлов" 9-класс. Цель урока. :. познакомить с природными соединениями металлов и с самородными металлами; дать ...Алкены. Гомологический ряд, номенклатура, изомерия, получения
Конспект урока на тему. «Алкены. Гомологический ряд, номенклатура, изомерия, получения». Цель:. - познакомиться с этиленовыми углеводородами, ...Алканы, получения, свойства и применение
Муниципальное бюджетное образовательное учреждение «Актанышская средняя общеобразовательная школа №1». Актанышского муниципального района Республики ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Химия
Содержит:9 слайд(ов)
Поделись с друзьями:
Скачать презентацию















![Примерно через час, а может быть и раньше, ржавчина исчезнет. Fe₃O₄ +5H₂C₂O₄ = FeC₂O₄ + 2Н [Fe(C₂O₄)₂] +4H₂O Примерно через час, а может быть и раньше, ржавчина исчезнет. Fe₃O₄ +5H₂C₂O₄ = FeC₂O₄ + 2Н [Fe(C₂O₄)₂] +4H₂O](https://prezentacii.org/upload/cloud/19/03/131396/images/thumbs/screen7.jpg)