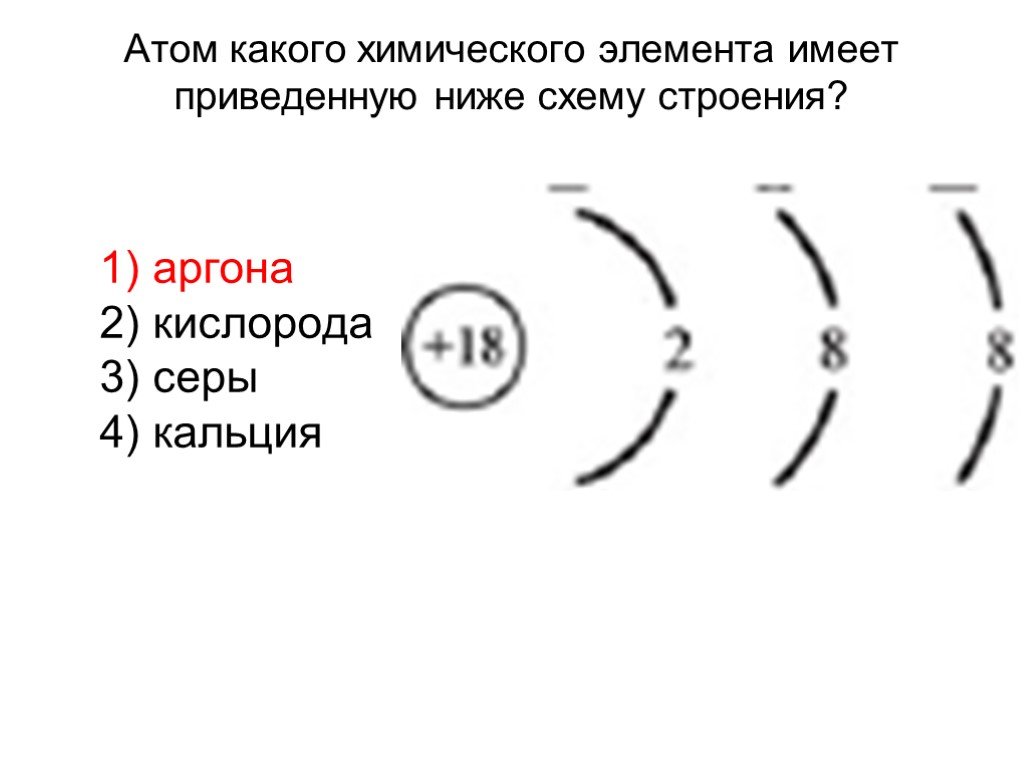
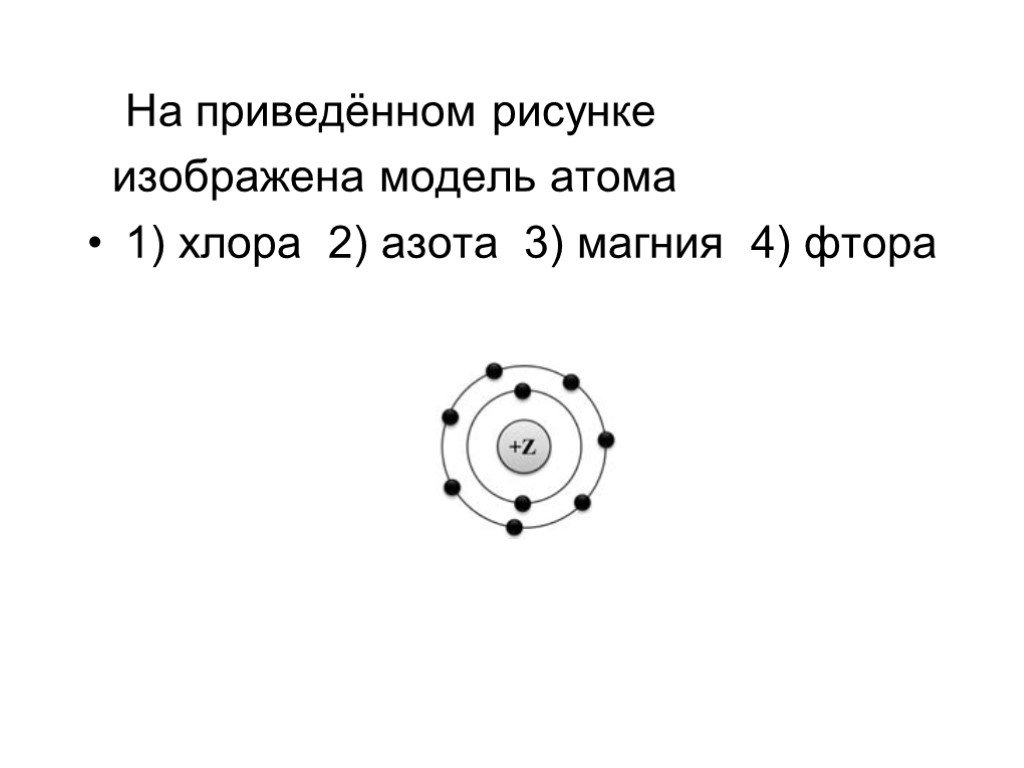
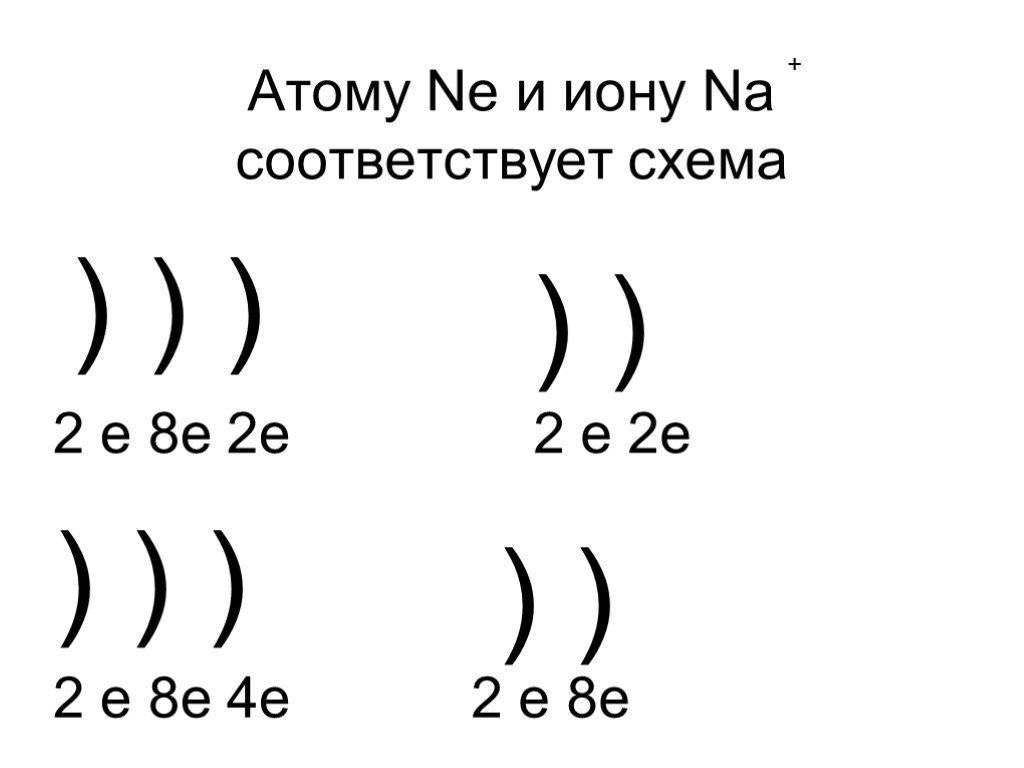
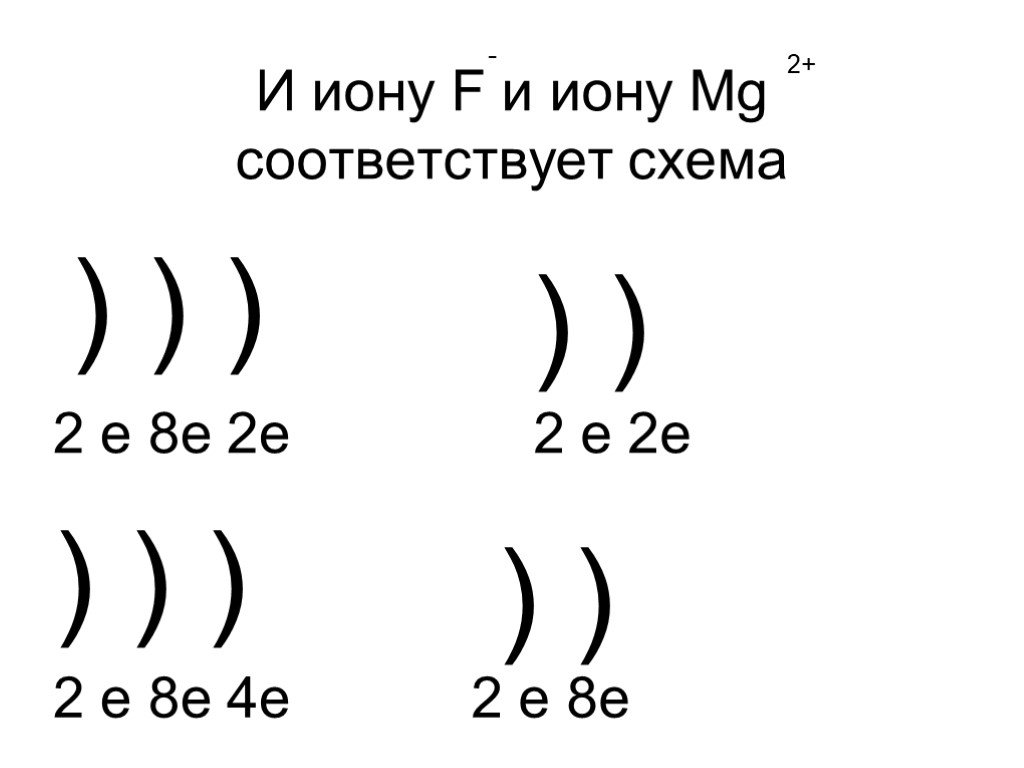
Презентация "Строение атома и его свойства" по химии – проект, доклад
Презентацию на тему "Строение атома и его свойства" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 59 слайд(ов).
Слайды презентации
Список похожих презентаций
Азот и его свойства
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Строение атома
Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле ! Демокрит. В основе философии ...Строение атома и атомного ядра
1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899 г. Эрнест ...Строение атома
СТРОЕНИЕ АТОМА. Студент должен:. Знать: Основные положения теории строения атома (ядра и состояния электронов), формулировку периодического закона ...Спирты: строение, свойства, применение
Подумайте! О каком веществе идет речь? Назовите тему урока? Что необходимо знать, чтобы аргументированно доказать свое согласие или несогласие с автором ...Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Строение атома
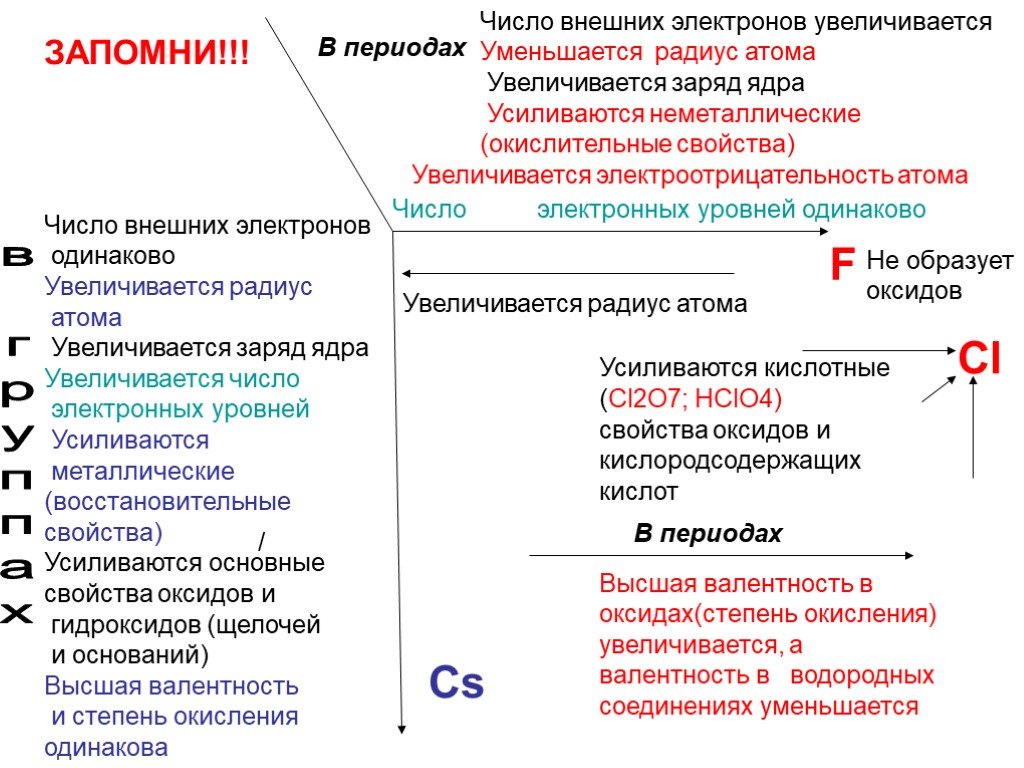
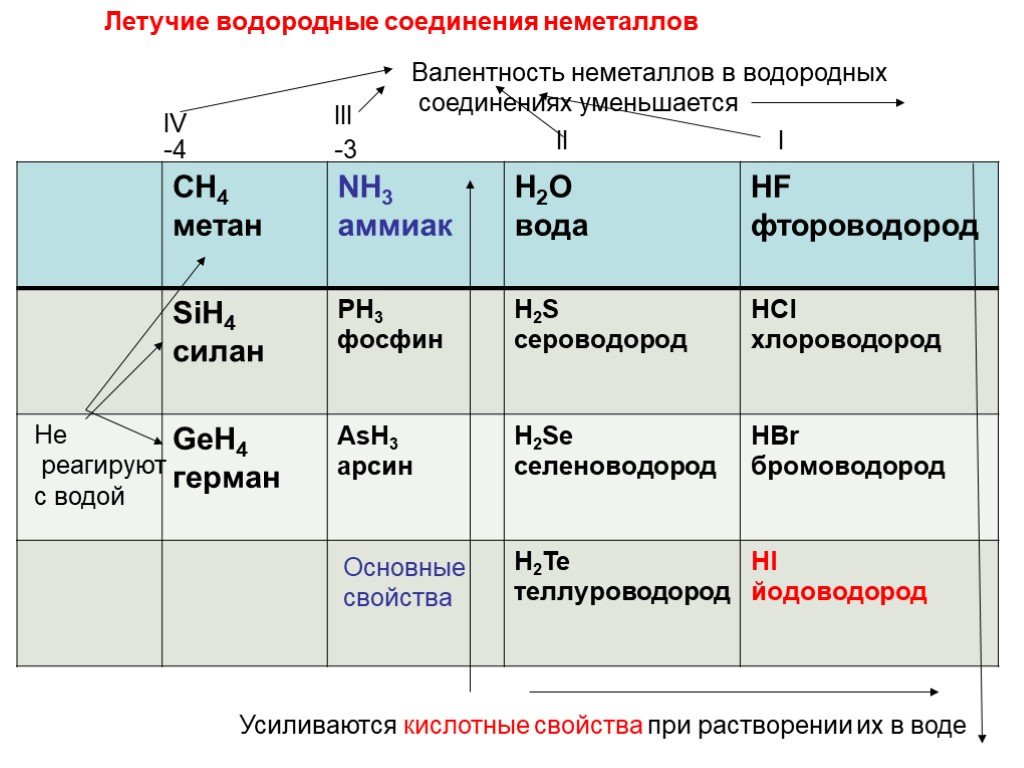
Химический элемент-это определенный вид атомов. Модель атома Резерфорда. протоны электроны нейтроны. Характеристики элементарных частиц. Количество ...Строение атома
Планетарная модель атома. электрон +. Общий заряд атома равен 0. - 3. Сравнение размеров ядра и электрона. Распределение электронов по электронным ...Стекло, его состав и свойства
М.В. Ломоносов 19.11.1711-15.04.1765. Физические свойства стекла. хрупкое, T пл. (оконного стекла) = 425 – 600˚С, ρ = 2,2 – 7 г/см имеет структуру ...Состав, строение и свойства белков
Цели и задачи урока:. Цель: с помощью видео-эксперимента исследовать состав, а так же некоторые физические и химические свойства белков Задачи: изучить ...Сложные эфиры. Жиры Строение, получение, свойства
Сложные эфиры. При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры: O O R1- C + R2 – OH R1- C +2H2O O ...Состав, строение и свойства стекла и хрусталя
Сырьевые материалы. Основные вещества - кварцевый песок, борная кислота, полевой шпат, каолин, известняк, поташ, сода, мел, окись цинка, сурик, окись ...Алюминий и его свойства
Алюминий и его свойства. ППС. Химическая активность. Взаимодействие с простыми веществами. Взаимодействие с сложными веществами. получение лабораторное ...Каучук и его свойства
Цель:. Ознакомление учащихся со свойствами натурального каучука его составом и строением, вулканизацией. План:. 1. История открытия каучука. 2. Натуральные ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Жиры: строение и свойства
Природные жиры. Жиры или триглицериды– природные соединения , представляющие собой сложные эфиры трехатомного спирта глицерина и высших карбоновых ...Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Аминокислоты и белки: строение и свойства
Аминокислоты. Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. . . . Незаменимые ...Аммиак: состав, строение, свойства, применение
История названия. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному ...Конспекты
Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия
Дата_____________ Класс_______________. Тема: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические ...Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа
Дата_____________ Класс_______________. Тема:. Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Азот. Строение атома и молекулы, свойства простого вещества
Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы ...Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. ОБЩАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81. Алюминий. Положение алюминия в периодической ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Фосфор и его свойства
Государственное казенное общеобразовательное учреждение Ростовской области. общеобразовательная школа-интернат основного общего образования. п. ...Альдегиды. Их строение, свойства, получение, применение
Мультимедийный урок по теме: "Альдегиды. Их строение, свойства, получение, применение". . Цели:. 1.Организовать деятельность учащихся по восприятию, ...Алкены :состав, строение ,номенклатура , изомерия ,физические свойства
Алкены :состав, строение ,номенклатура ,. изомерия ,физические свойства. Девиз: Величие человека в его способности мыслить. Цель урока :. познакомить ...Насыщенные одноатомные спирты: состав, строение, свойства, получение
Урок химии в 11 классе. Тема урока. . Насыщенные одноатомные спирты: состав, строение, свойства, получение. Тип урока. : изучение нового материала. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 ноября 2018
Категория:Химия
Содержит:59 слайд(ов)
Поделись с друзьями:
Скачать презентацию