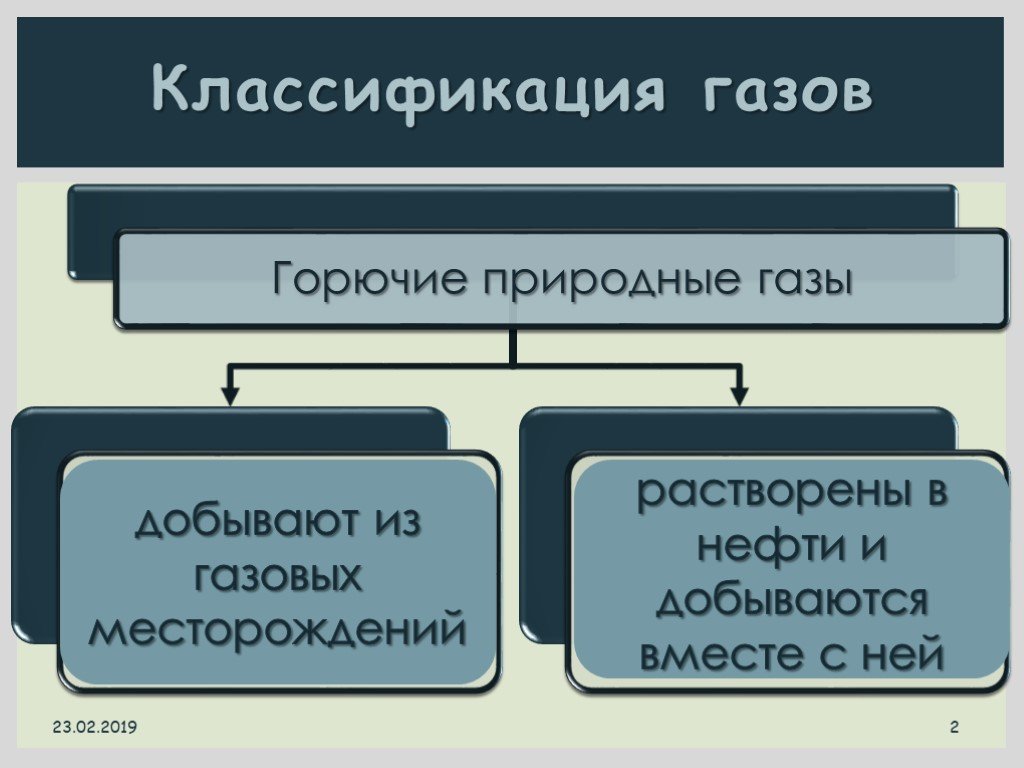
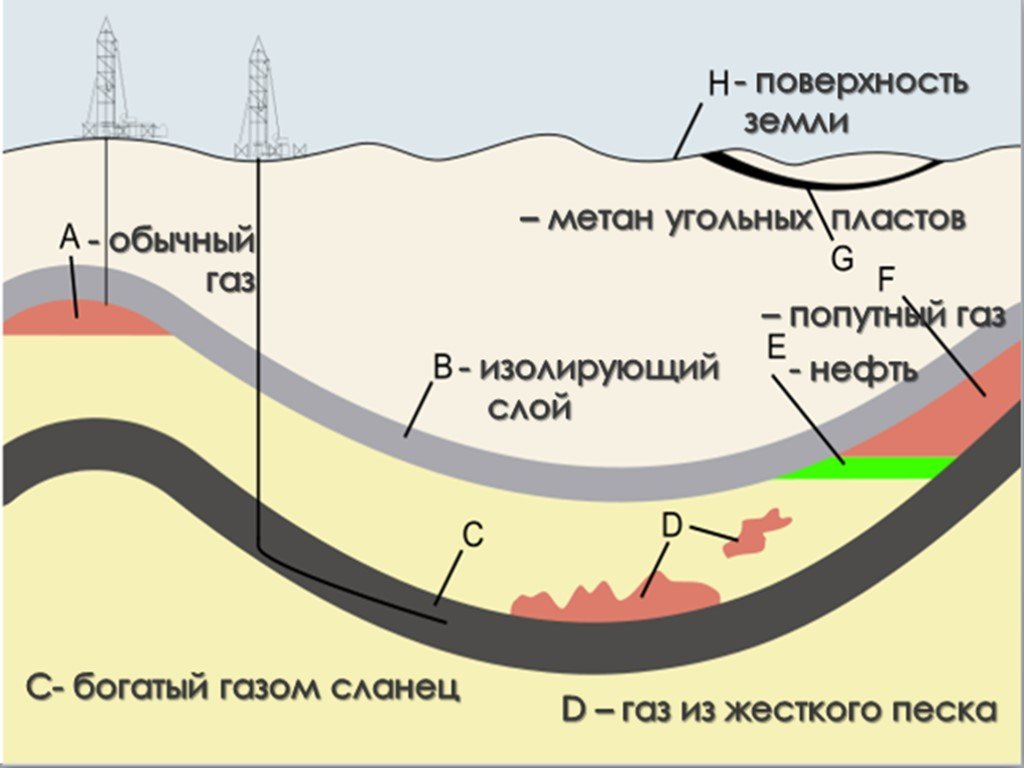
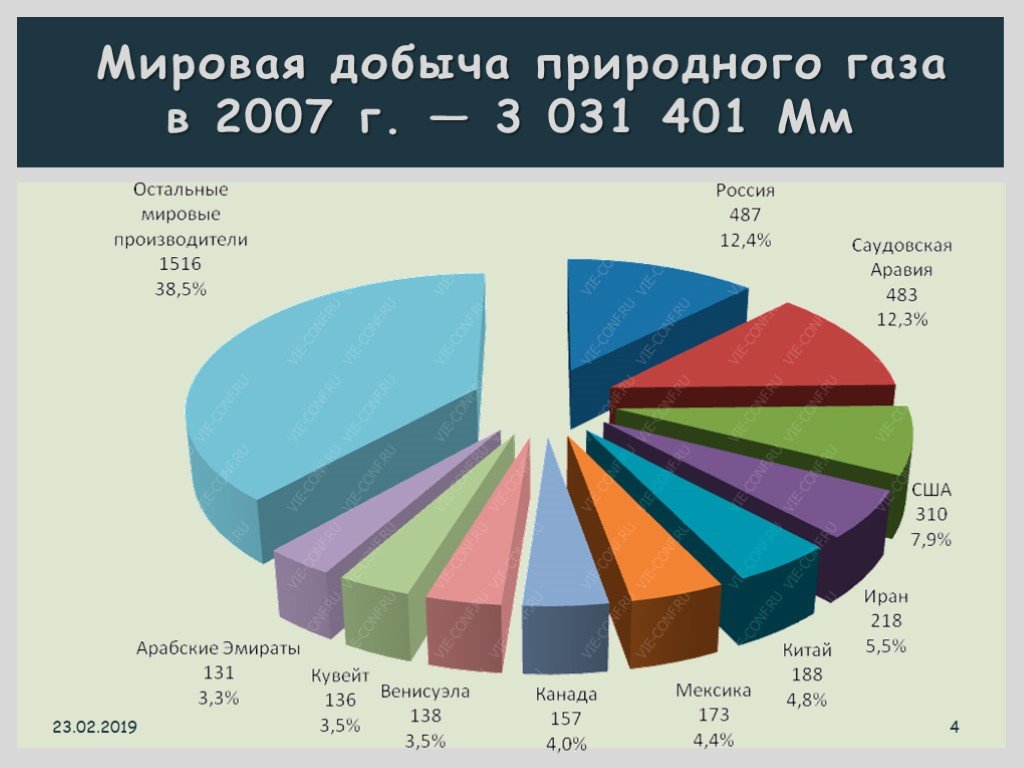
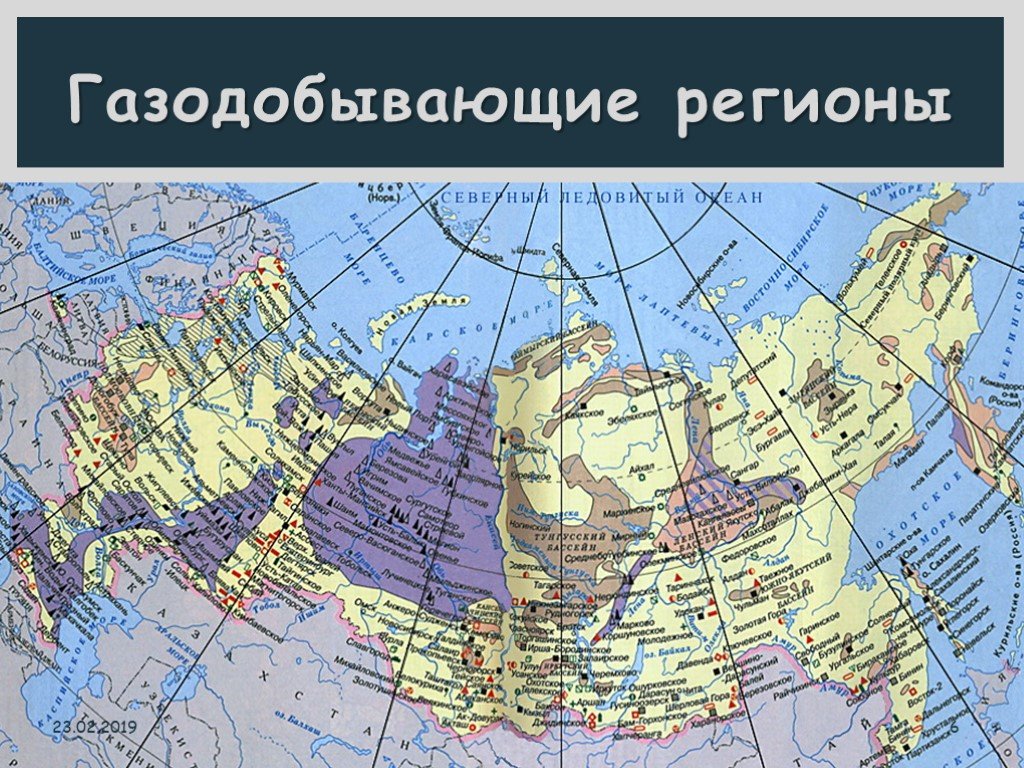
Презентация "Все о природном и попутном газе" по химии – проект, доклад
Презентацию на тему "Все о природном и попутном газе" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 35 слайд(ов).
Слайды презентации
Список похожих презентаций
Все об алюминии
АЛЮМИНИЙ. нахождение в природе. Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O. Строение атома. 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê ...Все о спиртах
Реши задачу! Определите молекулярную формулу соединения содержащего углерода- 52,2% водорода -13% кислорода-34,8%. Проверьте себя С2Н6О. Задание: ...Все о чае
История. Первоначально чай использовался в качестве лекарственного средства. Его употребление в качестве напитка широко распространилось во время ...Все о предельных одноатомных спиртах
Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Химические свойства Физиологическое действие спиртов Применение ...Все о пищевых добавках класса Е
С древних времён люди понимали важность питания для здоровья: «Ты есть то, что ты ешь», говорили они. Главные питательные вещества нашей пищu. Как ...Все о нуклеиновых кислотах
Проблемный вопрос. Подумайте и выскажите ваши предположения: А) Почему (в силу каких причин) именно молекулы ДНК, а не РНК выполняют функцию хранения ...проект: Все для фронта, все для Победы
«Наука есть источник высшего блага человечества в период труда. Но она и самое грозное оружие защиты и нападения во время войны» Н.Д.Зелинский Справедливо ...Все о многоатомных спиртах
Цели урока:. Закрепить полученные знания об одноатомных спиртах. Познать новое (многоатомные спирты) в сравнении с одноатомными, найти в общем частное, ...Все о железе и его соединения
Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса 2010 г. План изучения вещества. Железо как ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов. Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...Коллоидная химия
Признаки объектов коллоидной химии. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 февраля 2019
Категория:Химия
Содержит:35 слайд(ов)
Поделись с друзьями:
Скачать презентацию