Презентация "Изучение коррозии и защиты металлов" по химии – проект, доклад
Презентацию на тему "Изучение коррозии и защиты металлов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 34 слайд(ов).
Слайды презентации
Список похожих презентаций
Способы защиты от коррозии металлов
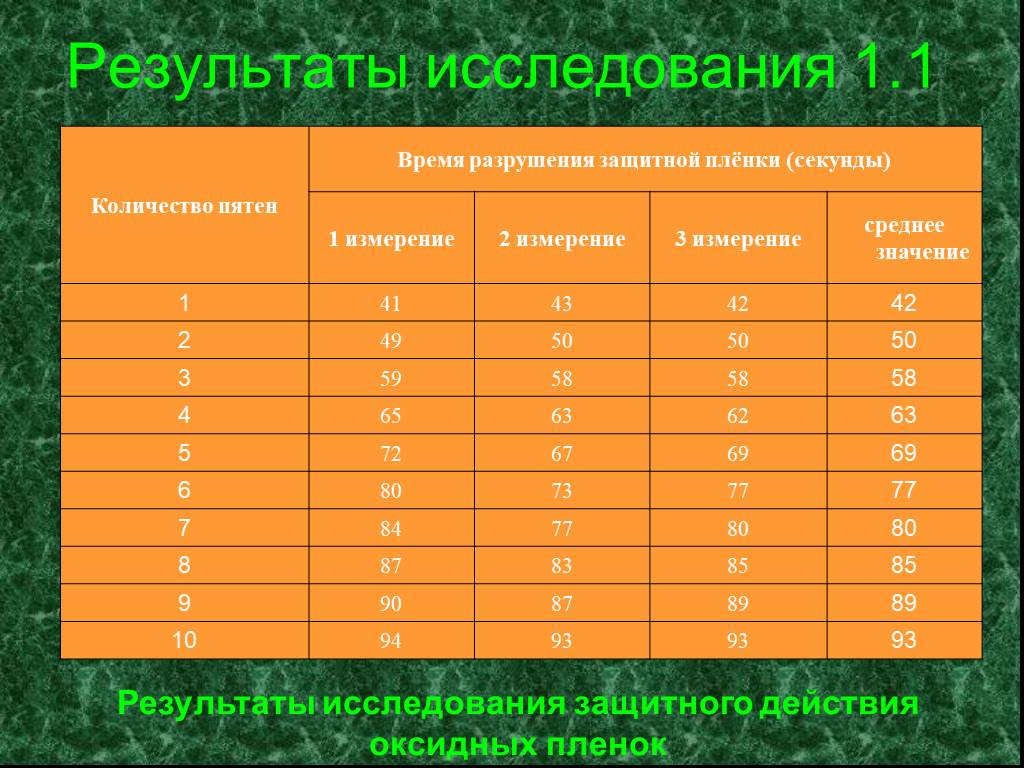
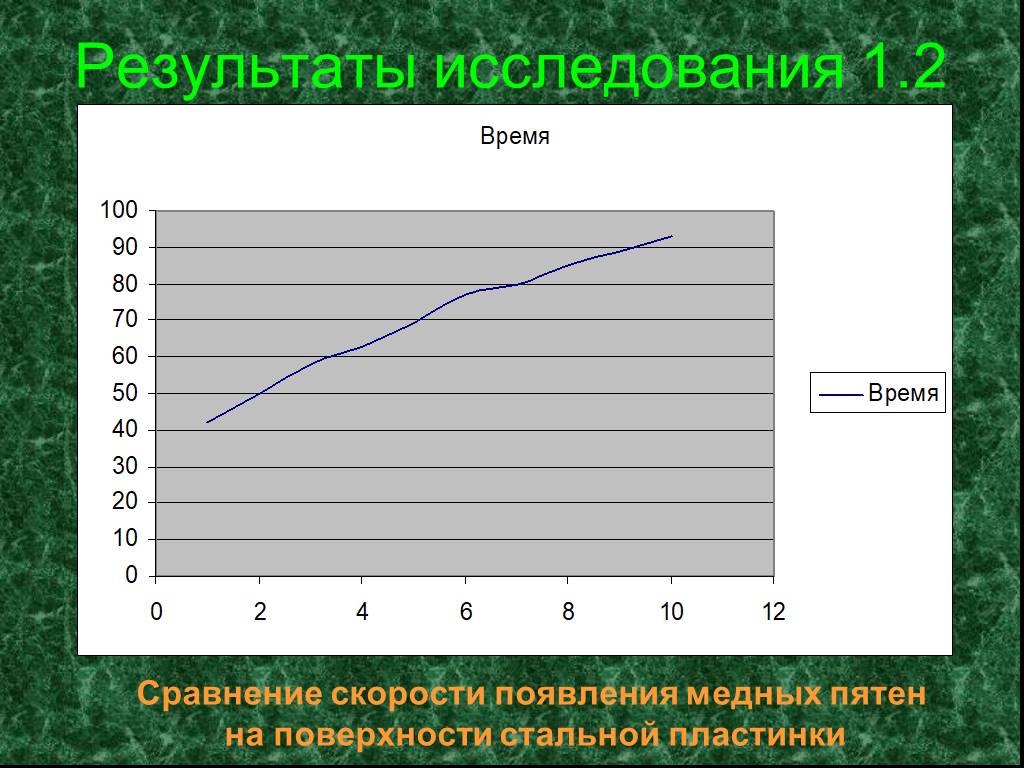
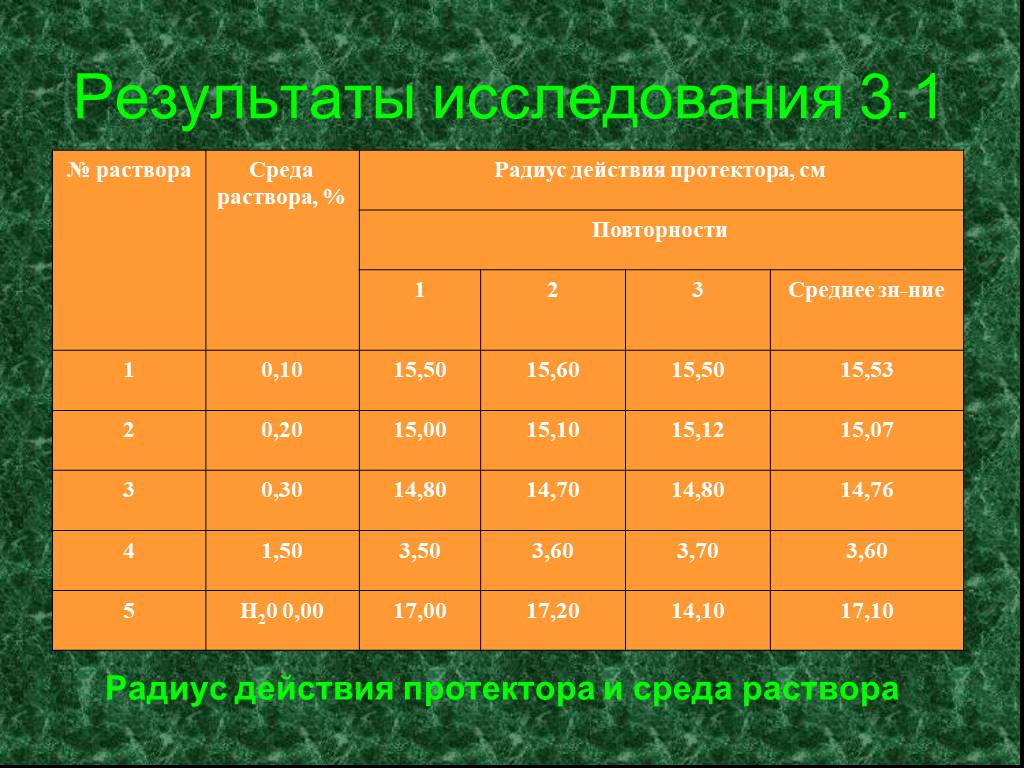
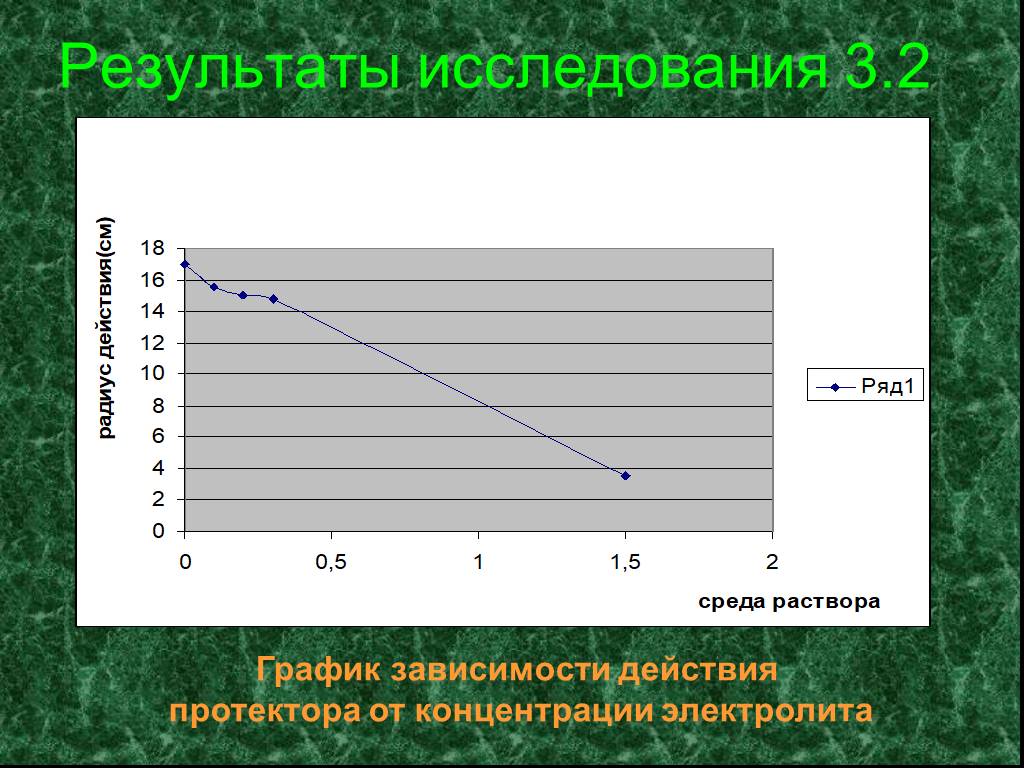
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств ...Изучение свойств оксидов металлов
Цель: определить характер оксидов металлов, имеющихся в школьной лаборатории (оксиды бария, железа, кальция, меди, свинца), изучить их свойства. Задачи: ...Скорость протекания коррозии и способы защиты от неё
Коррозия - проблема XXI века! Коррозия – рыжая крыса, Грызет металлический лом. В. Шефнер. Наша гипотеза: можно ли замедлить процесс коррозии, изучив ...Химические свойства металлов
Верите ли вы, что … Металлы занимают верхний левый угол в ПСХЭ. В кристаллах атомы металла связаны металлической связью. Валентные электроны металлов ...Строение атомов металлов
Домашнее задание. Параграф 8 По печатной тетради: На «3» - стр.7: № 6,9,10,11. стр.12: №4 На «4,5» - стр.8 №7,8; стр.11№16; стр.13 № 7(последний);стр.14 ...Способы получение металлов
Распространенность металлов в природе. Нахождение металлов в природе. Очень активные металлы. Неактивные (благородные). Средней активности. Важнейшие ...Сплавы металлов
Сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых по крайней мере один – металл. СПЛАВЫ. однородные ...Руды чёрных и цветных металлов
Цель:. Собрать материал о руде черных и цветных металлов. Задачи:. Ознакомится с учебным материалом; Изучить дополнительную литературу по данной теме; ...Положение металлов в таблице Д.И. Менделеева. Особенности строения атомов, свойства
Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи ...Применение металлов
Применение металлов. Каждый металл используется по-своему: Алюминий. Легкий и прочный металл, особенно в сплавах. Основной материал при создании самолётов. ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Электронная проводимость металлов
Лекция 13. Тема: Классическая теория электропроводности металлов. 13.1.Классическое представление об электропроводности металлов. Экспериментальные ...Изучение показателей качества чипсов и газированной воды
Выяснить, может ли «рядовой» потребитель, внимательно прочитав этикетку на упаковке, сделать правильный выбор между множеством товаров в пользу экологически ...Изучение отдельных тем базового содержания курса химии в 8 классе, на основе технологии полного усвоения
Проблема. Усвоение всеми учащимися базового содержания образования через обучение в соответствии с индивидуальными особенностями восприятия и усвоения. ...Изучение качества молока
Цель моего исследования: изучение качества различных видов молока. Для достижения поставленной цели я сформулировала следующие задачи: 1. рассмотреть, ...Изучение возможности интоксикации ионами алюминия организма человека через питьевую воду
Причины избытка алюминия в организме. острые отравления солями алюминия на производстве; избыточное поступление в условиях повышенного содержания ...Грозит ли миру военный конфликт из-за металлов?
Плотность металлов. Металлы Лёгкие ρ5 гр/см3. Вся авиационная техника построена на основе сплавов лёгких металлов. Ртуть плотность - 14,19 г/см3. ...Общая характеристика металлов главных подгрупп I-III
Характеристика металлов главной подгруппы I группы. Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы ...Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания
План. Введение Мониторинг изменения содержания углекислого газа в классном помещении в течении учебного дня. Определение оптимальных условий проветривания ...Получение металлов
Металлы в природе. Самородные металлы (золото, серебро, медь, платина ). Минералы (красный железняк, цинковая обманка, галенит, киноварь и т.д.). ...Конспекты
Коррозия металлов и способы защиты от нее
Урок № 37 9 кл. Тема: Коррозия металлов и способы защиты от нее. Цель: сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных ...Основные месторождения металлов и неметаллов в Казах¬стане и проблемы защиты окружающей среды при процессах добычи и переработке сырья
Урок №20, химия 10 класс. тема: Основные месторождения металлов и неметаллов в Казахстане. и проблемы защиты окружающей среды при процессах добычи ...Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии
Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии. Цели:. сформировать представление ...Химические свойства металлов
Тема: «Химические свойства металлов». Цель урока:. Сформировать понятие об общих химических свойствах металлов и их восстановительных способностях. ...Химические свойства металлов
. Тема урока. Химические свойства металлов. . Класс. . 11. . . Тип урока. . Изучение и первичное закрепление нового материала. ...Химические свойства металлов
Разработка урока по химии в 9-м классе по теме: "Химические свойства металлов". . Бодыкова Гульшат Зулхарнаевна. учитель. ница. химии. . . ...Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Способы получения металлов
Разработка урока для учащихся 10 класса. Тема урока. «Способы получения металлов». Цель урока:. . Рассмотреть запасы природных соединений металлов ...Роль металлов и их соединений в природной среде и в живых организмах
Дата. . . Предмет химия. . Класс 9 Урок 45. . . . Название занятия. . . Роль металлов и их соединений в природной среде. и в живых ...Причины мутаций. Пути атимутационной защиты
Методическая разработка интегрированного урока по химии и биологии в 11 классе с использованием ИКТ. Тема. : «Причины мутаций. Пути атимутационной ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 января 2019
Категория:Химия
Содержит:34 слайд(ов)
Поделись с друзьями:
Скачать презентацию







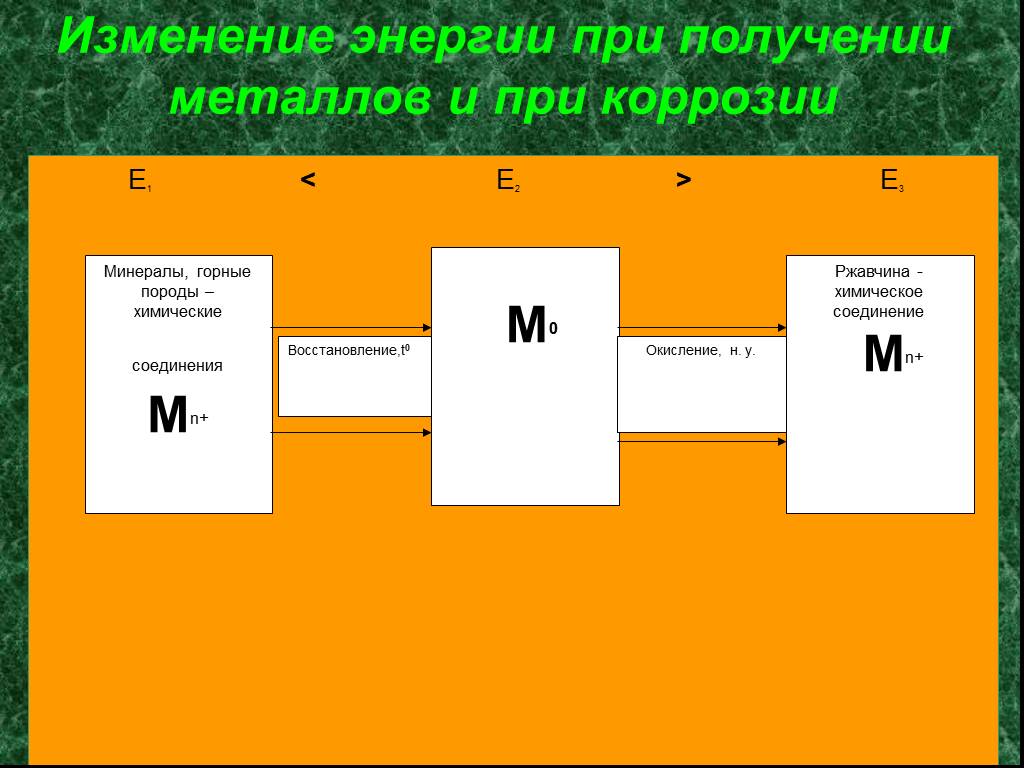







































![Результаты исследования 2.1. Стакан №1 а) система Zn – Fe: А (-) Zn e- → Zn2+ в растворе ↓ К(+)Fe → 2 e- + 2H+ (из раствора) = Н2 Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В. Е = Е0 (Fe2+ | Fe) - E0(Zn2+ | Zn); Е = [-0, 44 – (-0,76)] = 0, 32 В. Результаты исследования 2.1. Стакан №1 а) система Zn – Fe: А (-) Zn e- → Zn2+ в растворе ↓ К(+)Fe → 2 e- + 2H+ (из раствора) = Н2 Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В. Е = Е0 (Fe2+ | Fe) - E0(Zn2+ | Zn); Е = [-0, 44 – (-0,76)] = 0, 32 В.](https://prezentacii.org/upload/cloud/19/01/116955/images/thumbs/screen20.jpg)
![Результаты исследования 2.2. Стакан №2 б) система Fe – Sn: К(+)Sn → 2 e- + 2H+ (из раствора) = Н2 А(-)Fe e- → Fe2+ в растворе Е0 (Sn2+|Sn) = - 0,14 В; Е0 (Fe2+ | Fe) = - 0,44В. Е = E0 (Sn2+ | Sn) - Е0 (Fe2+| Fe) ; Е = [-0, 14 – (-0,44)] = 0, 30 В. 2K3[Fe(CN)6] + 3FeSO4 → Fe3[Fe(CN)6]2 ↓ + 3K2SO4 Результаты исследования 2.2. Стакан №2 б) система Fe – Sn: К(+)Sn → 2 e- + 2H+ (из раствора) = Н2 А(-)Fe e- → Fe2+ в растворе Е0 (Sn2+|Sn) = - 0,14 В; Е0 (Fe2+ | Fe) = - 0,44В. Е = E0 (Sn2+ | Sn) - Е0 (Fe2+| Fe) ; Е = [-0, 14 – (-0,44)] = 0, 30 В. 2K3[Fe(CN)6] + 3FeSO4 → Fe3[Fe(CN)6]2 ↓ + 3K2SO4](https://prezentacii.org/upload/cloud/19/01/116955/images/thumbs/screen21.jpg)