Презентация "Общая характеристика металлов главных подгрупп I-III" по химии – проект, доклад
Презентацию на тему "Общая характеристика металлов главных подгрупп I-III" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика неметаллов
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Строение атома. КИСЛОРОД. Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле; в воздухе - 21% по объему; ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Азот. Общая характеристика
Азот – это вечный источник танталовых мук человечества, это вечные терзания голода среди океана изобилия. М.Камен (американский биохимик). Источник ...Общая характеристика реакций органических соединений
Классификация органических реакций. I. По результату реакции делят на 1) реакции замещения , S , (substitution замещение). CH4 + Cl2 CH3Cl + HCl ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Общая характеристика оксидов
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2, Al2O3, CO. Оксиды. Оксиды – соединения элементов ...Характеристика щелочных металлов
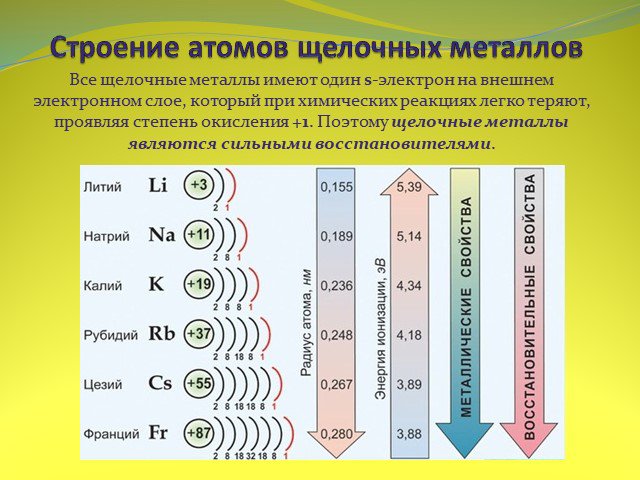
ПЛАН УРОКА. Строение атомов элементов главной подгруппы I группы. Щелочные металлы – простые вещества. Химические свойства щелочных металлов. Соединения ...Сравнительная характеристика металлов и их соединений
Пирит. Берилл. . Корунд (Al2O3). Рубин. Сапфир. Необычные кристаллы поваренной соли - "искусственные кораллы". Кристаллы соли Соляная шахта. Серебро. ...Характеристика щелочных металлов
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна ...Общая характеристика галогенов.
Цели: Охарактеризовать положение галогенов в Периодической системе Д.И.Менделеева. Охарактеризовать особенности строения атомов галогенов. Охарактеризовать ...Кислород. Общая характеристика, получение и свойства
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Общая характеристика галогенов
Цель урока:. Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики. Ответы ...Общая характеристика галогенов
Цели урока:. 1.Систематизировать знания учащихся о галогенах. 2.Ознакомить учащихся с окислительными свойствами галогенов. 3.Повторить, обобщить и ...Неметаллы-общая характеристика
Неметаллы. Общая характеристика Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si – 27%) C,H,O,N,P,S – биогенные элементы, составляют ...Положение металлов в таблице Д.И. Менделеева. Особенности строения атомов, свойства
Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи ...Влияние тяжёлых металлов на человека
Методика исследования. При взаимодействии ионов тяжелых металлов с иодидом калия образуются осадки разной окраски: Pb + 2 + 2 I - = PbI 2 ↓ (желтый) ...Конспекты
Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Общая характеристика металлов и неметаллов
П . лан- конспект урока "Общая характеристика металлов и неметаллов". . Девиз урока. : “Зажечь, увлечь и повести”. . Цели. В нетрадиционной ...Общая характеристика неметаллов
Тема урока «. Общая характеристика неметаллов. »,. 9 класс. Федотова Е. Г. учитель химии МБОУ СОШ №4 г. Южно-Сахалинск. Цель:. Используя антитезу ...Общая характеристика неметаллов
Конспект урока по химии. Тема урока: «Общая характеристика неметаллов». УМК:. Габриелян О.С. Химия 9 кл. Возраст: 9 класс. Учителя химии ...Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Общая характеристика неметаллов. Элементы V А группы. Важнейщие соединения азота. Фосфор и его соединения
План учебного занятия № 14. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Характеристика металлов II группы главной подгруппы
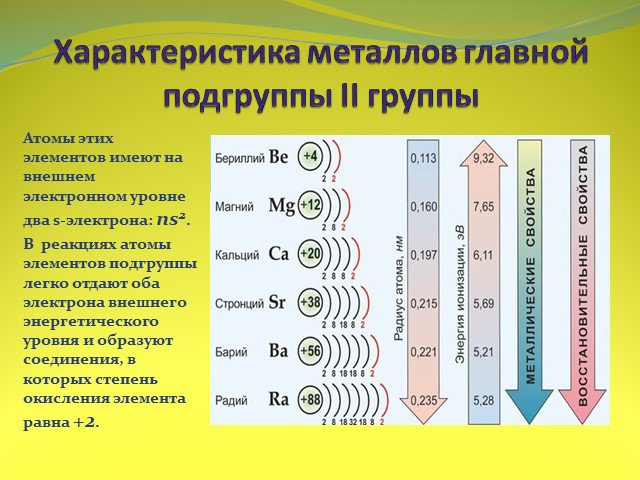
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Неметаллы. Общая характеристика неметаллов
. План-конспект урока химии в 9 -м классе с использованием ЦОР по теме: «Неметаллы. Общая характеристика неметаллов». Автор: Кобелева Вера Ивановна. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию










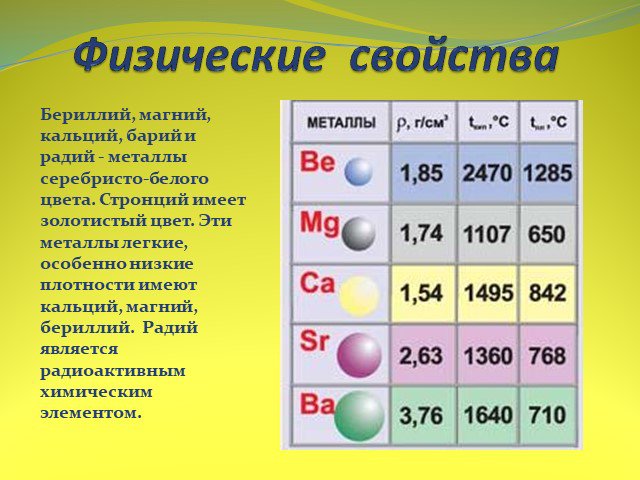































![Взаимодействие со щелочами. Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 Остальные металлы II группы с щелочами не реагируют. Взаимодействие со щелочами. Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 Остальные металлы II группы с щелочами не реагируют.](https://prezentacii.org/upload/cloud/15/01/13462/images/thumbs/screen17.jpg)
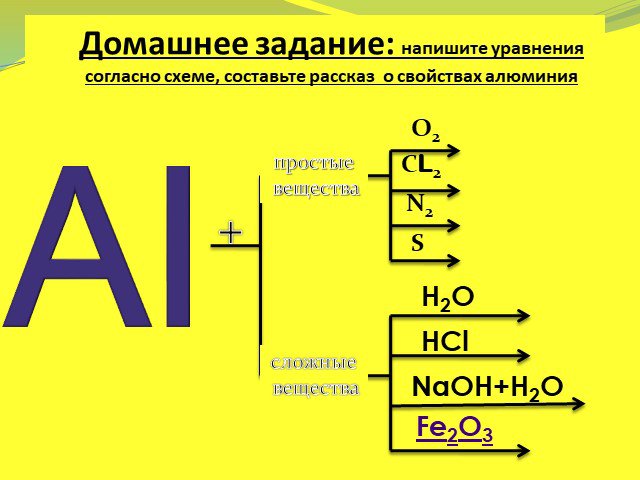
![Алюминий. 13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью Алюминий. 13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью](https://prezentacii.org/upload/cloud/15/01/13462/images/thumbs/screen18.jpg)


![Со сложными веществами: 4) С водой (после удаления защитной оксидной пленки): 2Al0 + 6H2O ® 2Al+3(OH)3 + 3H2 5) Со щелочами: 2Al0 + 2NaOH + 6H2O ® 2Na[Al+3(OH)4] (тетрагидроксоалюминат натрия) + 3H2 6) Легко растворяется в соляной и разбавленной серной киcлотах: 2Al + 6HCl ® 2AlCl3 + Со сложными веществами: 4) С водой (после удаления защитной оксидной пленки): 2Al0 + 6H2O ® 2Al+3(OH)3 + 3H2 5) Со щелочами: 2Al0 + 2NaOH + 6H2O ® 2Na[Al+3(OH)4] (тетрагидроксоалюминат натрия) + 3H2 6) Легко растворяется в соляной и разбавленной серной киcлотах: 2Al + 6HCl ® 2AlCl3 +](https://prezentacii.org/upload/cloud/15/01/13462/images/thumbs/screen21.jpg)