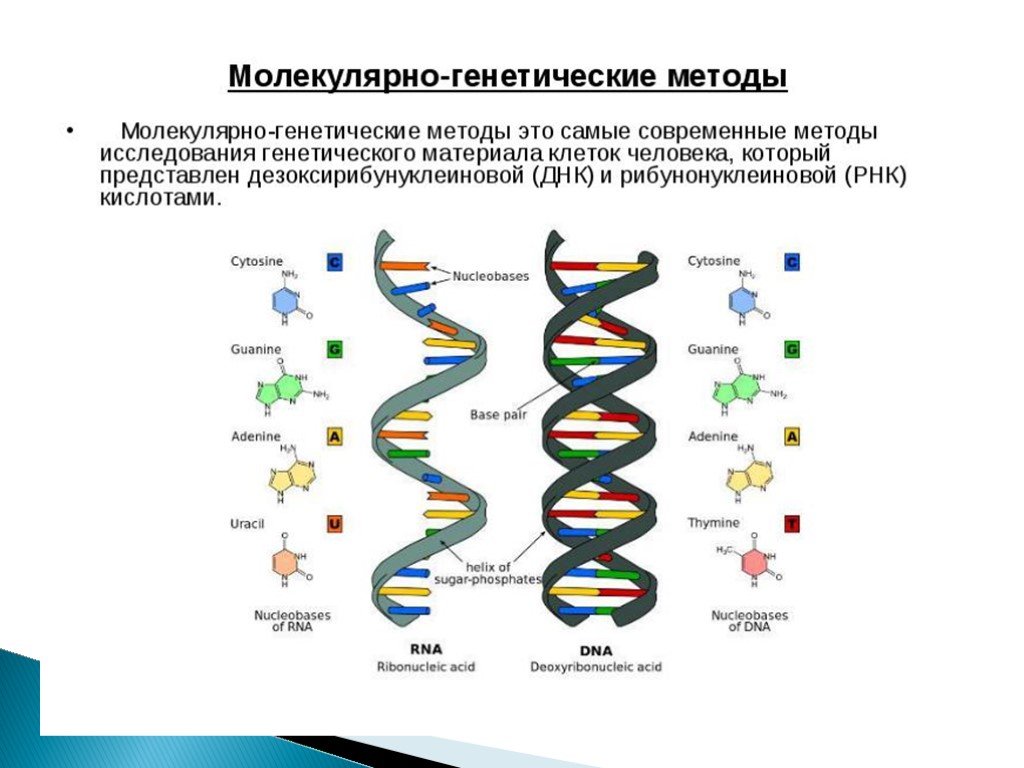
Слайд 1Молекулярно-генетическое исследовании
Слайд 2Тема : Молекулярно-генетическое исследование в ревматологии Выполнила: Бакир А.Г
Слайд 3Молекулярно-генетические исследования помогают диагностировать: Моногенные генетические заболевания; Вероятность развития онкологических болезней; Наличие факторов, провоцирующих мультифакторные болезни
Слайд 4Определение риска развития онко-процессов при помощи молекулярно-генетического исследования выявляет: Риск развития рака желудка и щитовидной железы; Вероятность возникновения рака толстой кишки и ранних стадий этого заболевания; Генетическую предрасположенность к развитию рака тела матки, яичников, молочной и предстательной железы; Наличие рекомбинации генов ABL/BCR, выявляемых при лейкозах; Наличие предпосылок, обеспечивающих эффективность противоопухолевой терапии гефатинибом при наличии немелко-клеточного рака .
Слайд 5Проводя молекулярно-генетические тесты на наличие генетически обусловленных предпосылок развития мультифакторных заболеваний, удается выявить риск развития: гипертонической болезни; преэклампсии; ревматоидного артрита; остеопороза; нарушений липоидного обмена; сахарного диабета 1 и 2 типа; болезней репродуктивной системы.
Слайд 6КОМУ НАЗНАЧАЮТ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ Молекулярно-генетические тесты показаны лицам: страдающим бесплодием; подвергающимся воздействию неблагоприятных факторов окружающей среды; имеющим в роду близких родственников, страдающих онкологическими, психическими, сосудистыми и эндокринными заболеваниями.
Слайд 8Первый этап молекулярно-генетического анализа очень важный и заключается в получении РНК и ДНК образцов, которые являют собой отдельные фрагменты ДНК клетки или всю её цепочку. Для выделения необходимого количества фрагментов используют способ амплифицирования, то есть их размножения путем полимеразной цепной реакции (ферментативная репликация). Для анализа молекул ДНК требуется их предварительное деление на части и обработка бактериальными эндонуклеазами (рестриктазами) – ферментами, которые могут разрезать двойную спираль ДНК на части по 4-6 пар.
КАК ПРОВОДИТСЯ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ ТЕСТ
Слайд 9Фрагменты ДНК разделяют по длине и размеру при помощи специального геля (полиакриламидного и агарозного), применяя электрофорез. Под действием последнего они перемещаются вниз по гелю с разной скоростью, оставляя за собой дискретную полосу.

Слайд 10Молекулярно-генетические исследования наследственных патологий также используют с целью изучения человеческого генома. Блот-гибридизация по Саузерну позволяет в данном случае определить необходимые для этого особые фрагменты ДНК. При этом вначале прибегают к денатурации ДНК, в результате чего получают фрагменты в виде одной цепочки и их переносят на фильтр (нейлоновый или нитроцеллюлозный), который замочен в буферном растворе. Гель, на котором находятся ДНК-фрагменты, переносят на фильтровальную бумагу с солевым раствором (с высоким %концентрации). Сверху накладывается по очереди нитроцеллюлозный фильтр и фильтровальная, но сухая бумага (для впитывания солевого раствора). В итоге одноцепочечные ДНК остаются на фильтре в таком же положении как на геле.

Слайд 11Метод Саузерна позволяет воссоздать рестрикционную карту генома человека в определённой части гена. Это дает возможность обнаружить наличие любых дефектов в самом гене. Разработанные методы считаются довольно эффективными и позволяют проводить сверхточную диагностику наследственных заболеваний. С этой целью из эмбриональных клеток, которые содержатся в амниотической жидкости, выделяют ДНК. В последующем ее гибридизируют, применяя Саузерн-блоттинг с радиоактивным ДНК-зондом. В итоге очень легко распознать аномальный эмбрион, потому что его ДНК гибридизируется исключительно с ДНК-зондом, который является комплементарным мутантной последовательности.

Слайд 12Заболевания, которые возникают в результате совместного воздействия факторов внешней среды и некоторых генов, называются полигенными. У таких заболеваний практически нельзя назвать какую-то одну основную причину, вызвавшую их. Однако гены играют очень важную роль в патогенетическом механизме полигенных (имеющих наследственную предрасположенность) патологий. Одним из представителей полигенных заболеваний является ревматоидный артрит. Сегодня нельзя уверенно сказать, что этиология (причины) ревматоидного артрита выяснена до конца. Именно поэтому ученые всех стран мира ведут активную работу по выявлению генетических и средовых факторов, отвечающих за происхождение данного заболевания. Для этого проводятся молекулярно-генетические, иммуногенетические, популяционно-генетические, близнецовые и генеалогические методы исследования. Результаты работы российских и зарубежных ученых показывают, что в основе развития ревматоидного артрита генетические факторы играют большую роль, чем неблагоприятное воздействие факторов внешней среды. По мнению ученых, генами «предрасположенности» к ревматоидному артриту являются ген рецепторов фактора опухоли и ген CD – 40, которые находятся на одном из участков Х-хромосомы

Слайд 13Еще одним геном предрасположенности к ревматоидному артриту считается ген IDDM9. Японские исследователи математически вывели, что наличие данного гена повышает риск развития ревматоидного артрита на 27%. Немаловажную роль в этиологии и патогенезе заболевания играет Т-клеточный иммунитет. В связи с этим ген TCRD (рецепторов Т–клеток) также является ответственным за возникновение ревматоидного артрита. Результаты целого ряда исследований показали, что мутация гена р53 приводят к возникновению его аномальных функций, что вызывает развитие костной деструкции. При ревматоидном артрите у многих пациентов отмечается аномальный биосинтез Fas-белка, вызванный мутацией Fas-гена. Исследования по выявлению в геноме человека генов «предрасположенности» к ревматоидному артриту продолжаются уже более четверти века. Полученные на сегодняшний день результаты являются весьма впечатляющими, однако работы будут продолжаться и дальше, что, возможно, позволит полностью понять этиологию и патогенез данного заболевания, а, следовательно, и разработать наиболее эффективные методы его лечения.

Слайд 14Международная группа исследователей обнаружила 42 новые генетические предпосылки, увеличивающие риск заболевания ревматоидным артритом.
Слайд 15Научно-исследовательская группа сравнила ДНК страдающих артритом пациентов с ДНК здоровых людей и обнаружила 42 области, которые, скорее всего, связаны именно с этим заболеванием. Есть надежда, что эта информация поможет разработать новейшие лекарства, компенсирующие подобные неисправности на генетическом уровне. Ревматоидный артрит – одна из главных причин инвалидности по всему миру. По оценкам ВОЗ, это заболевание поражает одного человека из ста. Около половины взрослых людей с аутоиммунным заболеванием теряют способность работать полный рабочий день в течение 10 лет после установления диагноза.

Слайд 16HLA-B27 - основной иммуногенетический маркер высокой предрасположенности к развитию анкилозирующего спондилита (болезнь Бехтерева) и других связанных серонегативных спондилоартропатий. Продукт гена HLA-B27 - антиген HLA-B27 - относится к молекулам главного комплекса гистосовместимости первого класса, MHC-I (MHC-major histocompatibility complex), которые участвуют в представлении пептидных антигенов для их распознавания Т-лимфоцитами. Это важно для формирования иммунного ответа на чужеродные антигены. Набор HLA антигенов уникален для каждого человека. Гены МНС I класса расположены в трех локусах (А, В и С) на коротком плече 6-ой хромосомы и отличаются высокой степенью полиморфизма. Установлено, что генетические вариации индивидуального набора этих антигенов связаны с разной восприимчивостью к различным заболеваниям. Для гена HLA-B известно 136 аллельных вариантов. Частота встречаемости аллеля 27 локуса В (HLA-B27) варьирует в зависимости от географического региона и этнической группы; различают также субтипы HLA-B27. Cреди европейцев HLA-B27 встречается в среднем в 7-10% популяции. В то же время установлено, что его встречаемость значительно выше среди больных некоторыми заболеваниями. В 1973 году была установлена связь гена HLA-B27 с анкилозирующим спондилитом. Наличие HLA-B27 при этом заболевании выявляется почти у 90% пациентов. Вероятность развития спондилоартропатии у человека, который является носителем HLA-В27, в десятки раз выше, чем у человека без данного гена (риск развития у здоровых лиц, положительных по HLA-B27, составляет около 2%).

Слайд 17В настоящее время установлена связь этого гена и с другими заболеваниями. Антиген HLA-B27 выявляется у большинства лиц, заболевших серонегативными спондилоартропатиями. Это разнородная группа заболеваний, в которую входят: анкилозирующий спондилит (болезнь Бехтерева), псориатический артрит, реактивный артрит, синдром Рейтера, артрит при воспалительных заболеваниях кишечника, рецидивирующий увеит, ювенильный ревматоидный артрит. В клинической симптоматике всех этих заболеваний отмечается артрит периферических суставов и суставов осевого скелета, кроме того, при этих заболеваниях обычно не находят ревматоидный фактор и другие аутоантитела. Именно последний феномен позволяет назвать их «серонегативными». Совокупная встречаемость этих заболеваний в популяции составляет около 0,5%, что позволяет отнести их к часто встречающимся аутоиммунным заболеваниям. Роль молекулы HLA-B27 в патогенезе серонегативных спондилоартропатий окончательно не установлена. Среди гипотез обсуждается роль архитектоники этой молекулы - особенностей конформационной укладки тяжелых цепей молекул HLA-B27, возможная роль молекулярной «мимикрии» чужеродных антигенов, презентируемых HLA-B27 (ряда бактерий желудочно-кишечного или урогенитального тракта) и собственных антигенов. В частности, в качестве соответствующих инфекционных триггеров HLA-B27-зависимых реактивных артритов, подтверждается роль Salmonella, Shigella, Yersinia.

Слайд 18Клиническое подозрение на серонегативные спондилоартропатии у детей и взрослых требует иммуногенетического исследования наличия гена HLA B27. Этот тест не является определяющим исследованием, которое позволяет точно поставить диагноз, либо исключить его. Однако, учитывая низкую частоту встречаемости HLA-B27 в европейской популяции, его выявление у пациента при наличии клинических проявлений, соответствующих этой группе ревматических заболеваний, значительно увеличивает вероятность данного диагноза.