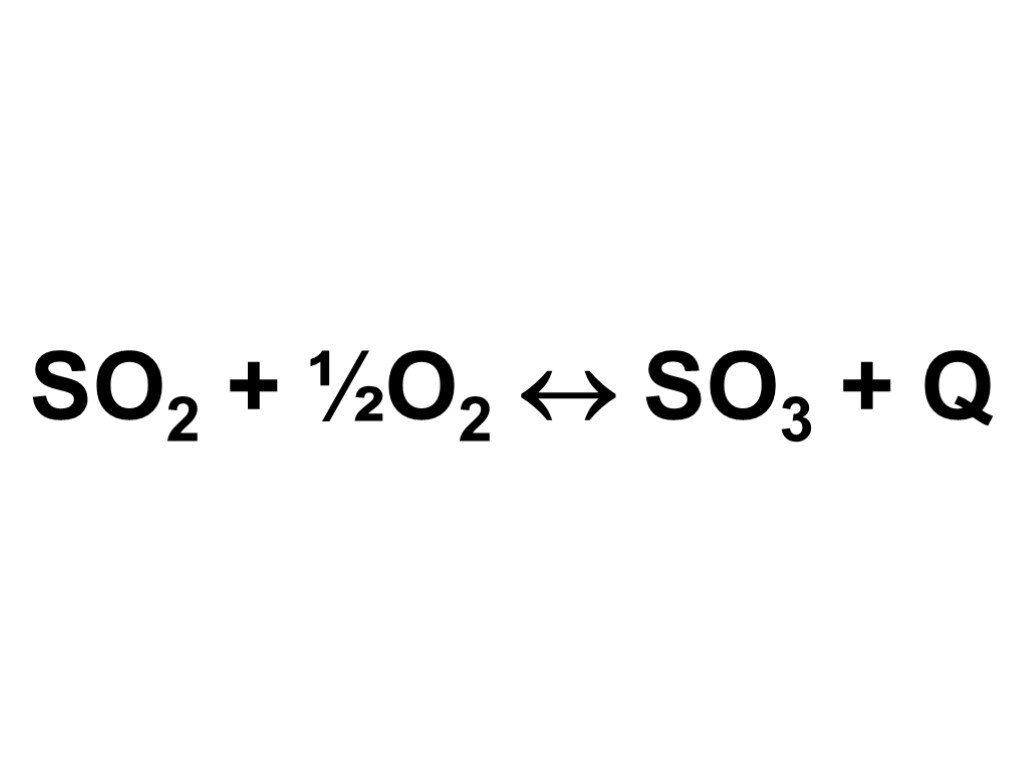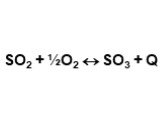Презентация "Производство серной кислоты" по химии – проект, доклад
Презентацию на тему "Производство серной кислоты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Производство серной кислоты
Сырьё. FeS2 - пирит, серный колчедан, железный колчедан S8 самородная ромбическая сера H2S – сероводород Сu2S; ZnS; PbS – сульфиды цветных металлов ...Производство серной кислоты
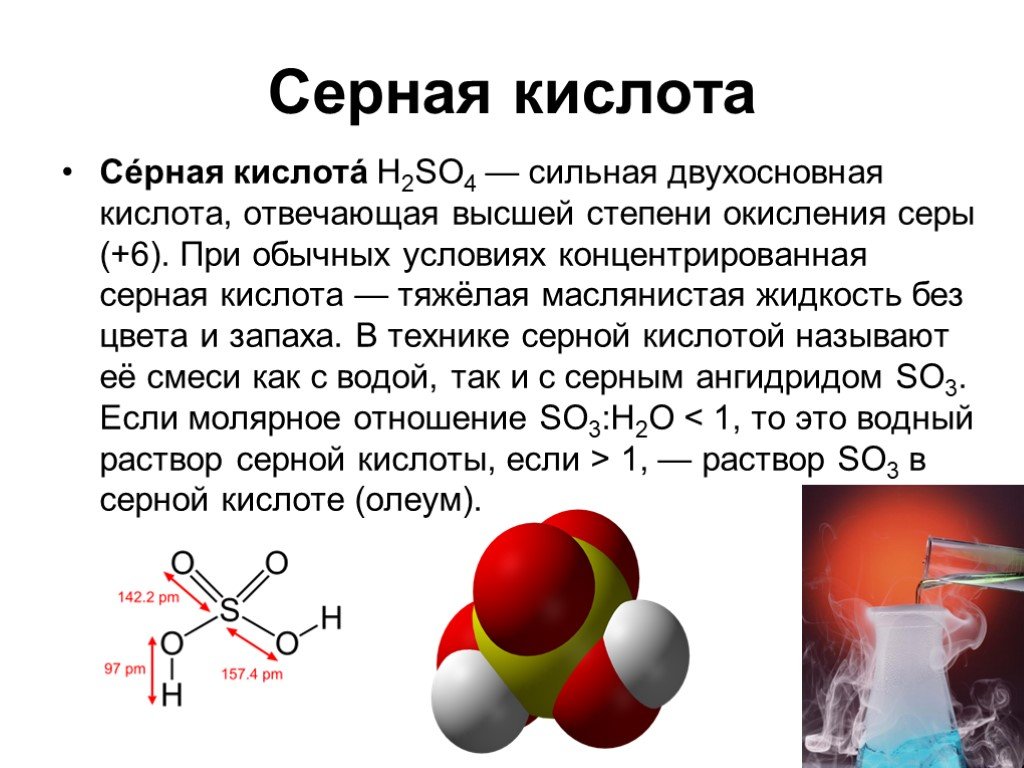
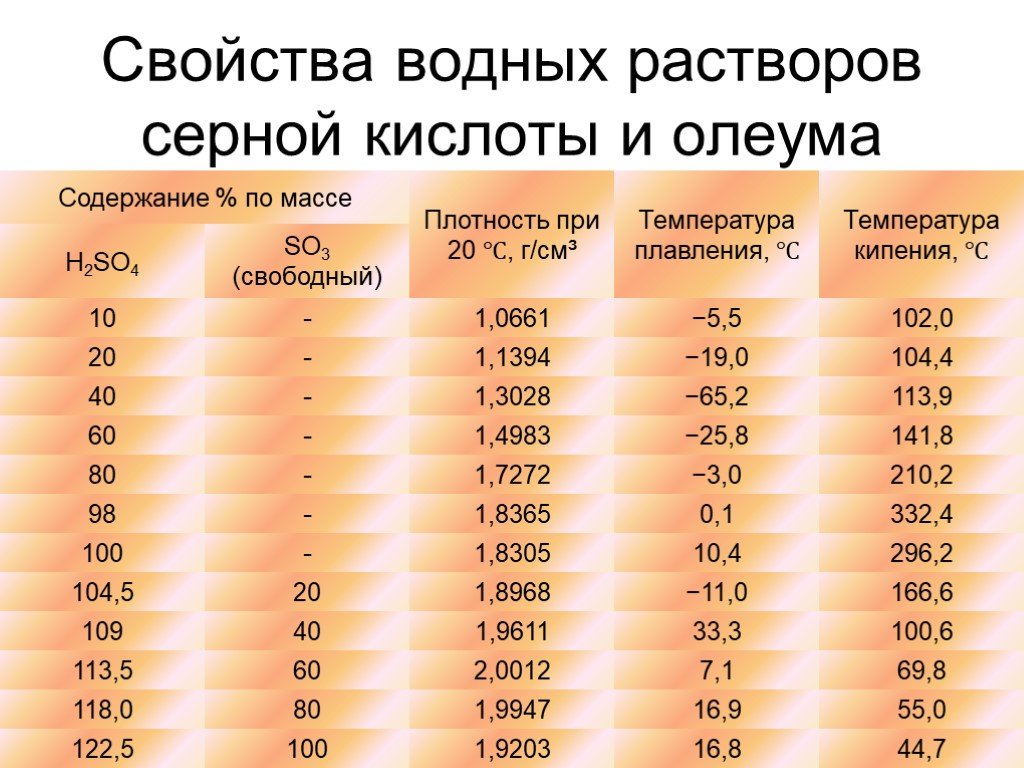
Серная кислота. H2SO4 cуществует в природе как самостоятельное химическое соединение, представляет собой бесцветную маслянистую жидкость без запаха ...Производство серной кислоты
Цель: обобщить сведения о стадиях и принципах, используемых при промышленном производстве серной кислоты. Рифмованные строчки. Для закрепления сейчас ...Производство серной кислоты (польза и вред)
Цель работы:. Узнать: из чего получают серную кислоту; как получают серную кислоту; для чего получают серную кислоту; вредно ли производство серной ...Производство серной кислоты контактным способом
Сырьё, используемое для производства серной кислоты:. 1. Самородная сера S 2. Пирит (серный колчедан) FeS2 3.Сероводород H2S 4. Сульфиды цветных металлов ...Производство серной кислоты контактным способом.
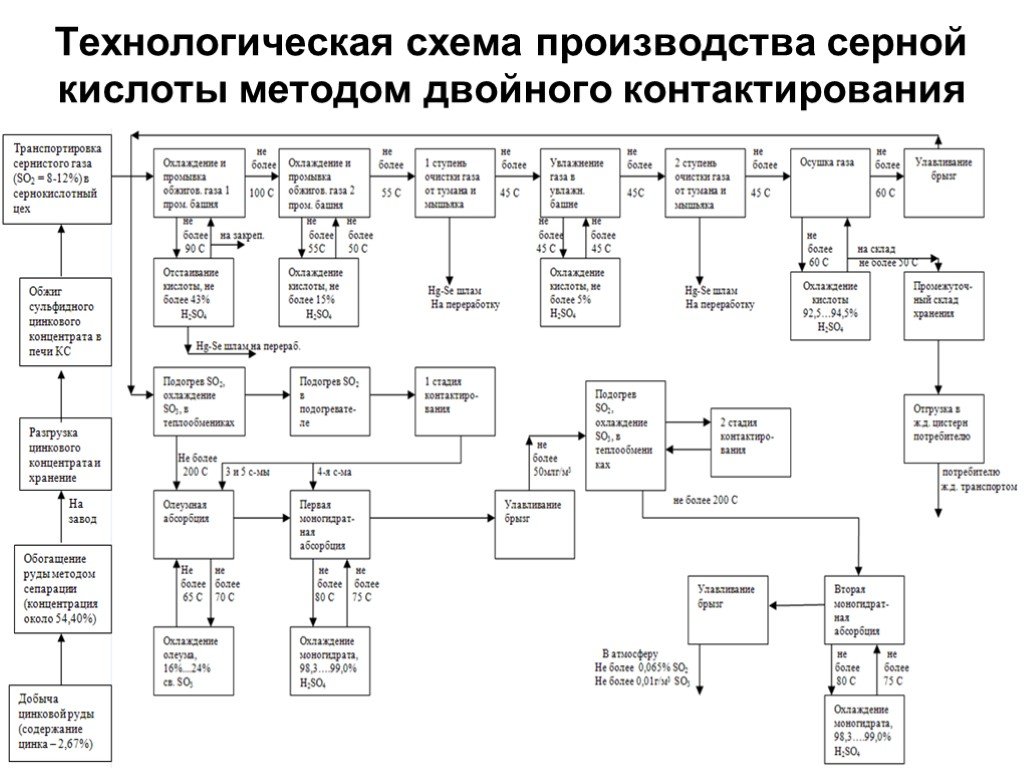
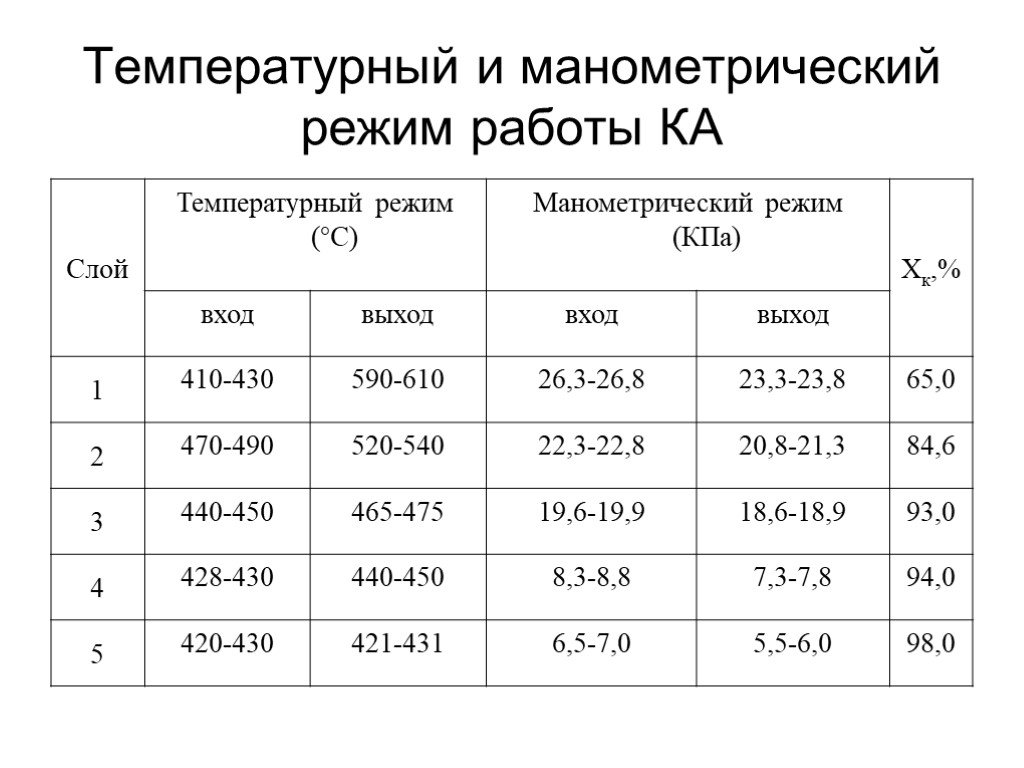
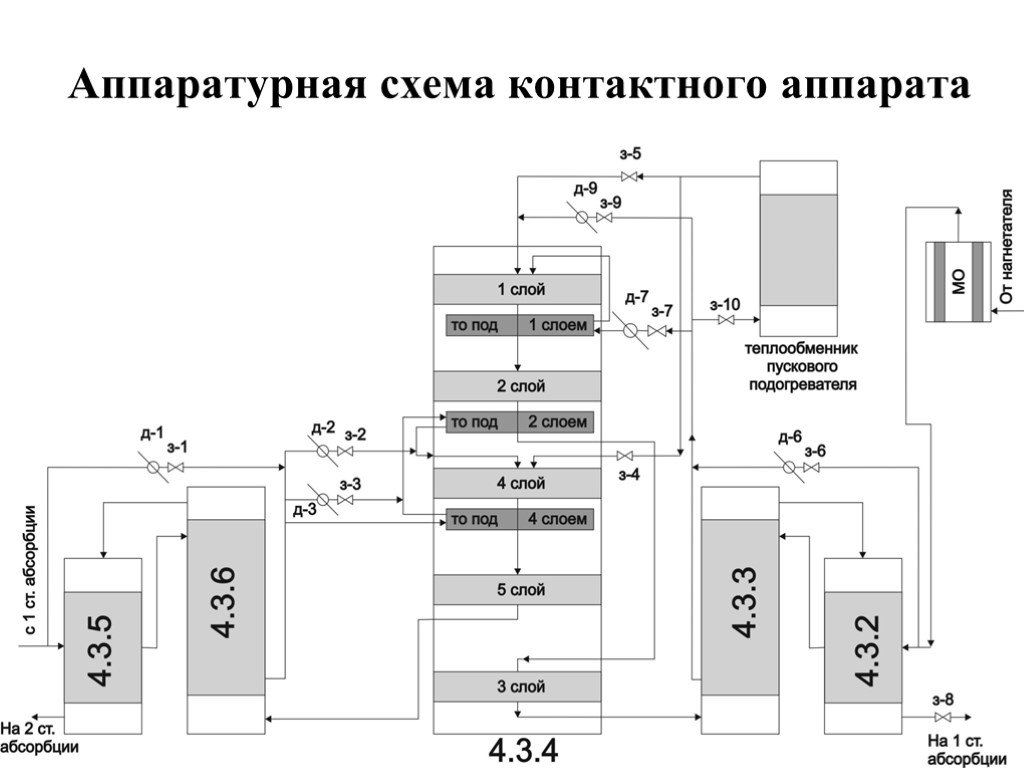
газ. Сжигание серного колчедана, при этом образуются печной газ SO2 и огарок Fe2O3 : 4FeS2 +11O2→2Fe2O3+8SO2. Печь для обжига в кипящем слое. Циклон ...Производство серной кислоты
Сернокислотные заводы. Пирит обыкновенный. Черный пирит. Самородная сера. Сероводород. Сульфиды цветных металлов. Подготовка сырья. Измельчение пирита. ...Химические свойства серной кислоты
Ход урока:. Повторение предыдущей темы: 1. Что такое кислота с точки зрения ЭД. 2. Формула серной кислоты, валентность атома серы и степень окисления. ...Воздействие серной кислоты на углеводы
Углеводы. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся ...Нитрозный способ получения серной кислоты
Реагенты. Медь Азотная кислота Сульфит натрия Раствор серной кислоты 70%. Приборы. Две колбы Вюрца Трехгорлая колба 2 газоотводных шланга Штативы ...Серная кислота, свойства серной кислоты
Состав. Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток H-R, где R-кислотный остаток При электролитической ...Производство мыла
Знать – хорошо, но уметь – лучше. Гейбель ИСТОРИЯ 1. «ВОПРОСИТЕЛЬНАЯ» В этом учебном году мы начали изучать органическую химию и перед нами открылся ...Производство алюминия
ПЛАН ИЗУЧЕНИЯ АЛЮМИНИЯ: 1. Алюминий – химический элемент 1.1. Положение в ПСХЭ; 1.2. Строение атома. 2. Алюминий – простое вещество. 2.1 Нахождение ...Производство аммиака
Изучить научные принципы производства аммиака. Цель. Задачи. Разработать оптимальные условия синтеза аммиака. Составить технологическую схему производства. ...Угольная и кремниевая кислоты и их соли
Напишите уравнения соответствующих реакций в ионном виде. Na2CO3 →NaHCO3 →Na2CO3. Запишите уравнения реакций, соответствующих схеме. Качественные ...Предельные одноосновные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых ...Карбоновые кислоты
Общая формула карбоновых кислот: 1) R – СНО 2) R – СООН 3) R – СН2 – ОН 4) R – СО – О – R΄. Карбоксильную группу содержат молекулы: 1) сложных эфиров ...Муравьиная и уксусная кислоты
Карбоновые кислоты очень часто встречаются в нашей жизни .Человек использует их практически во всех сферах жизни, наиболее используемые это муравьиная ...Неорганические кислоты
Кислотный остаток. Задание классу. Прослушайте аудиозапись определения кислот. Ответьте на вопросы:. 1.В данном ряду найдите формулу кислоты. Поясните. ...Конспекты
Производство серной кислоты
Производство серной кислоты. . Сырьё для получения:. самородная ромбическая сера, пирит (серный колчедан, железный колчедан), сульфиды цветных ...Производство серной кислоты контактным способом
Салищева О. льга Георгиевна. . Федеральное государственное казенное общеобразовательное учреждение «СОШ №3» г. Приозерск. . учитель химии. ...Окислительные свойства концентрированной серной кислоты
Дата_____________ Класс_______________. Тема: Окислительные свойства концентрированной серной кислоты. Цели урока:. ознакомиться с окислительными ...Химические свойства серной кислоты
Урок химии, 9 класс, 45 мин. разработан учителем химии МОУ «Рамешковская СОШ» Габлиной В.И. Тема: Химические свойства серной кислоты. Цели: Сформировать ...Химические свойства серной кислоты
. Химические свойства серной кислоты. Данный урок- презентация по теме « Химические свойства серной кислоты» позволяет реализовать ...Свойства серной кислоты
Свойства серной кислоты. Девиз: "Наши знания суть зерна наших творений". . . Г. Бюффон. Цели. : повторить строение молекулы серной кислоты, ...Производство азотной кислоты
ПЛАН-КОНСПЕКТ УРОКА. «Производство азотной кислоты. ». . 1. ФИО:. Семёнычева Лариса Витальевна. 2. Место работы:. МОУ СОШ №12. 3. Должность:. ...Пути познания серной кислоты
Пути познания. серной кислоты. Познание - это солнечный свет, без которого не может развиваться человечество. Н.Бердяев. «. О мощности государства ...Приключения серной кислоты
Урок - сказка «Приключение Серной Кислоты». (9 класс). Цели урока: Закрепить и проверить знания учащихся по теме «Подгруппа кислорода», сравнить ...Окислительные свойства серной кислоты
Конспект урока. Данные об учителе: Загребина Анастасия Павловна. учитель МБОУ Июльской СОШ, 1 категория, запрашиваемая 1 категория. Предмет. : химия. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 ноября 2018
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию