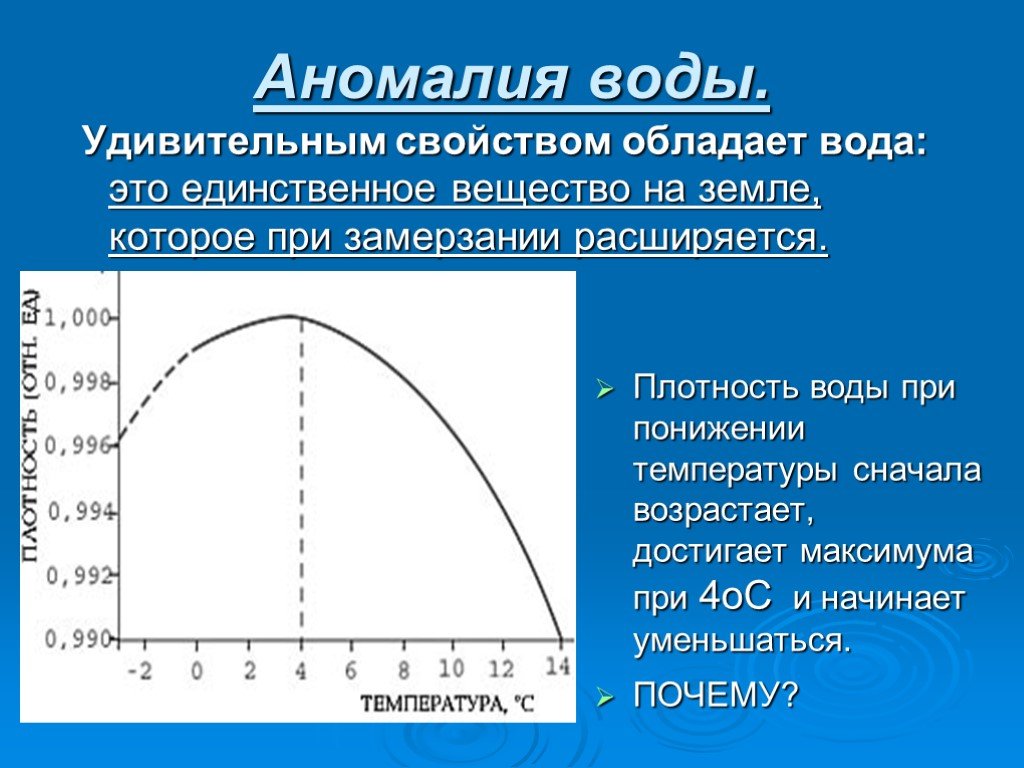
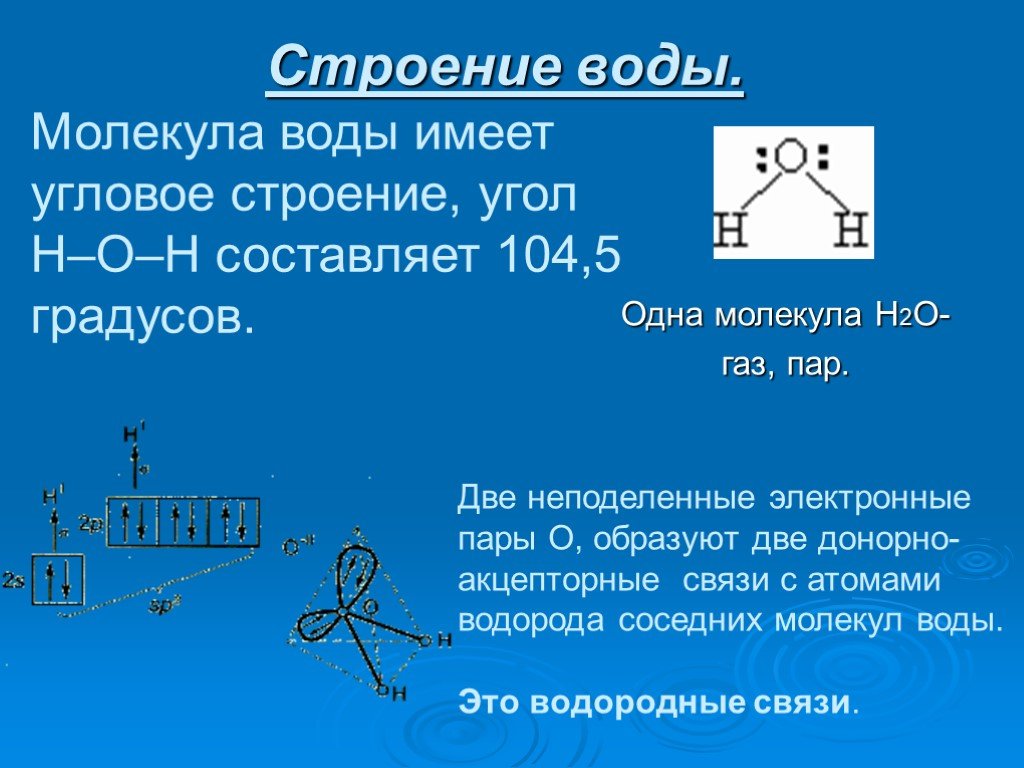
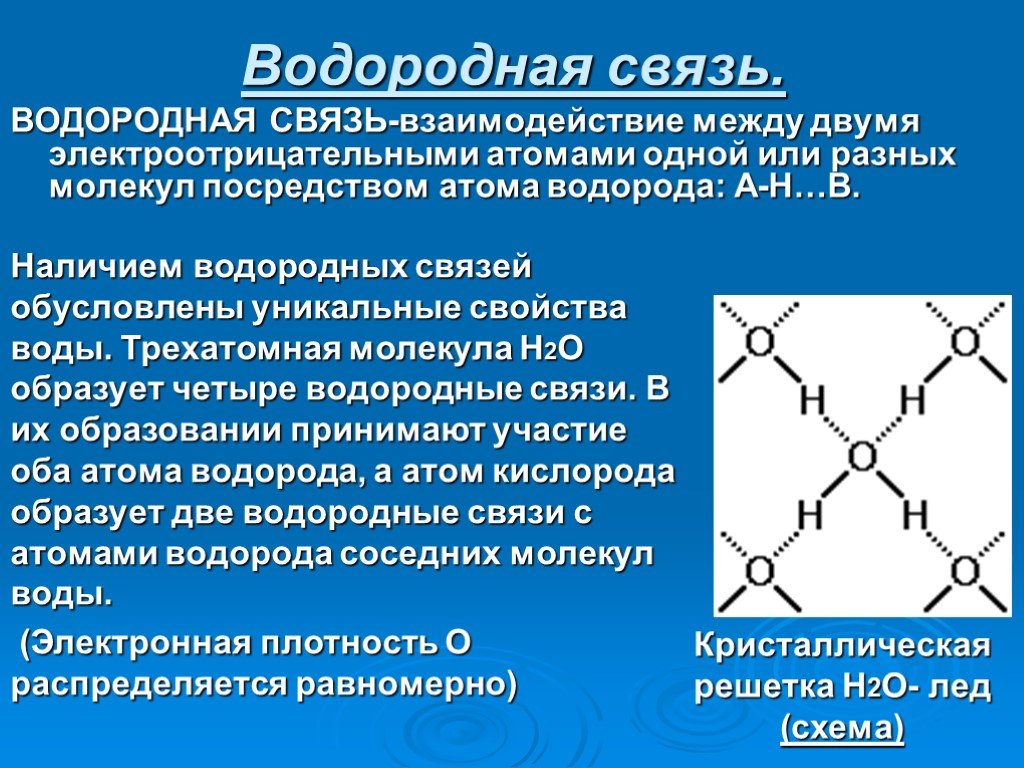
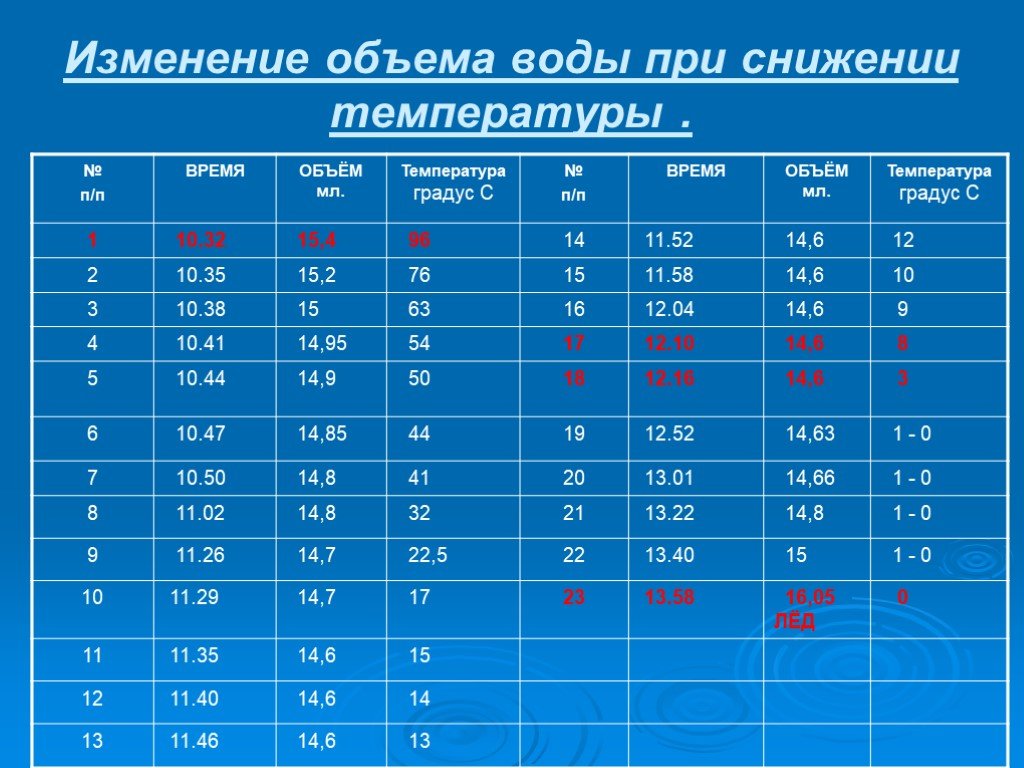
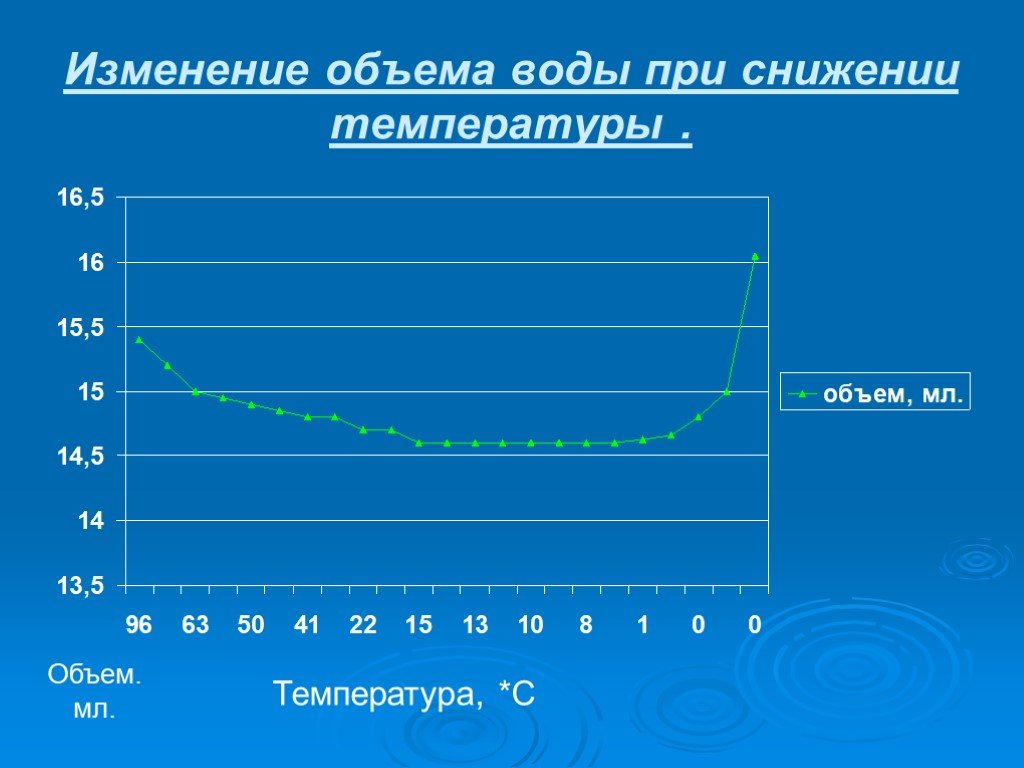
Презентация "Вода при замерзании" по химии – проект, доклад
Презентацию на тему "Вода при замерзании" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Вода в природе и жизни человека
Цель урока: обобщить, проанализировать и расширить знания о воде, ее роли в живой и неживой природе, в жизни человека, о необходимости бережного отношения ...Устранение дефектов при росте кристалла медного купороса
Применение кристаллов. Оптика Электроника. Природные кристаллы. Кварц Антимонит Вода. Медный купорос CuSO4 х 5H2O. Цель работы: изучение возможности ...Система заданий как средство формирования приемов умственной деятельности при изучении темы «Химический элемент»
Третий лишний. Вычеркните символ элемента, выпадающего из общего ряда. Возможен не один вариант правильного ответа Ключ: названия, написание знаков, ...Раздел химии. Вода и ее свойство
Тема 2.1. Раздел химии. Вода и ее свойство. Вопрос 1. Введение в химию. Теоретические основы химии. В зависимости от того, какие вещества изучает ...Получение сивушных масел и спирта при брожении углеводов
Fusel oil (сивушные масла). Смесь изомеров бутилового и амилового спиртов: ОН СН3-СН-СН2-СН3 СН3-С-СН3 ОН СН3 СН3-СН2-СН-СН2-СН3 СН3-СН - СН-СН3 ОН ...Использование Диофантовых уравнений при решении задач в математике и химии
Цель: Рассмотреть использование неопределенных уравнений при решении задач в математике и химии. Диофант Александрийский -древнегреческий математик ...Вода Самое удивительное вещество
Вода в природе. Советский учёный В. И. Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться ...Вода как вещество
Содержание. Состав и строение молекулы. Методы определения состава веществ. Вода в природе. Методы очистки воды. Физические свойства. Химические свойства. ...Вода - это жизненно важная составляющая здоровья каждого из нас
Введение. «Вода! У тебя нет ни вкуса, ни запаха ,ни цвета. Тебя не возможно описать! Тобою наслаждаются, не ведая что ты такое… Нельзя сказать ,что ...Вода - самое удивительное вещество на Земле
Вода – самое распространенное и самое удивительное вещество на Земле. Вода окружает нас повсюду: в водоемах, на земле и даже в воздухе – в виде снега, ...Вода - растворитель. Растворы
Я и туча, и туман, И ручей, и океан, И летаю, и бегу, И стеклянной быть могу! Мы говорим: она течёт; Мы говорим: она играет; Она бежит всегда вперёд, ...Вода - растворитель
жидкое вещество, в котором растворяются другие вещества. вещество, которое растворилось в растворителе. Растворённое вещество. Растворитель. Великолепный ...Вода
УДИВИТЕЛЬНОЕ О ВОДЕ. •По итогам сравнения 122 стран, проводимым ЮНЕСКО,самые чистые запасы пресной воды находятся в Финляндии. •Около 1 млрд. людей ...Вода
«Земля людей» Антуана де Сент-Екзюпері. Книга примушує замислитися над словами: «Вода! Ти не маєш смаку, ні кольору, ні запаху, тебе не можливо описати, ...Вода
Вода — рідина без кольору, запаху, смаку і з нульовою калорійністю — абсолютно необхідна для всіх видів життя на Землі. Без води не зможуть прожити ...Физико-химические процессы, происходящие при изготовлении теста
Вопросы: 1) Сырье хлебопекарного производства. 2) Физико-химические процессы, происходящие при изготовлении теста. Сырье хлебопекарного производства. ...Беземская И.В._Презентация к уроку_по теме Вода
А Б В Г. « Просто знать – еще не все, знания нужно уметь использовать» Гете. «Просто знать – еще не все, знания нужно уметь использовать» Гете. Бинарными ...Вода – важнейшая составляющая жизни на Земле
Введение:. Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и ...Вода как растворитель
Проверка домашнего задания. Решение задач. 1. Если в чайник или кастрюлю налить воду до краев и начать нагревать, то через некоторое время вода начнет ...Вода – растворитель
Отгадайте загадку. А ну, скорей снимите, шляпу! Я дочь космического папы. И вездесуща и легка,- Я лед, я пот, я- облака. Я иней, чай, бульон, туман, ...Конспекты
Вода в природе. Потребление воды в быту и на производстве. Жесткость воды и способы его устранения. Минеральные воды, их использование столовых и лечебных целях
Тема:. . Вода в природе. Потребление воды в быту и на производстве. Жесткость воды и способы его устранения. Минеральные воды, их использование ...Вода в природе. Состав, свойства и применение воды
Дата:. 26.02. 15 г. Предмет:. химия, 8 класс. Тема: Вода в природе. Состав, свойства и применение воды. ЦЕЛЬ:. . Сформировать знания о распространении ...Вода в природе. Физические свойства и применение воды
8 класс - химия. Тема урока:. . Вода в природе. Физические свойства и применение воды. . Цели и задачи урока. :. . 1) Обобщить и систематизировать ...Вода – удивительное вещество в природе
Республика Хакасия. . УО « Усть – Абаканский район». МБОУ « В-Биджинская СОШ». Урок химии. в 8 классе. « Вода – удивительное вещество ...Кислород. Вода
ПЛАН-КОНСПЕКТ УРОКА «Кислород. Вода.». (Тема урока). . ФИО (полностью). . Николаева Елена Петровна. . . . Место работы. ...Вода, как растворитель веществ
Тема урока: «Вода, как растворитель веществ». Цели урока:. . формирование учебно-познавательного интереса к новому способу действия через работу ...Вода, вода – ты везде и всегда
Северо-Казахстанская область, Тайыншинский район. КГУ «Чкаловская средняя школа №1». Интегрированный урок химии. . и русской литературы ...Вода
Северо. -. Казахстанская область. Акжарский район. Алкатерекская средняя школа. Учитель химии и биологии. Сагындыкова ...Фенол. Экологические аспекты при изучении темы
МОУ Малодубенская СОШ. д. Малая Дубна. Орехово-Зуевского района. Московской области. Урок по теме. 10 класс. ...Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным оборудованием и нагревательными приборами
Муниципальное общеобразовательное бюджетное учреждение. «Средняя Общеобразовательная школа № 7. . г.Соль-Илецка»Оренбургской области. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 ноября 2018
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию