Презентация "Характеристика неметаллов" по химии – проект, доклад
Презентацию на тему "Характеристика неметаллов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 47 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика неметаллов
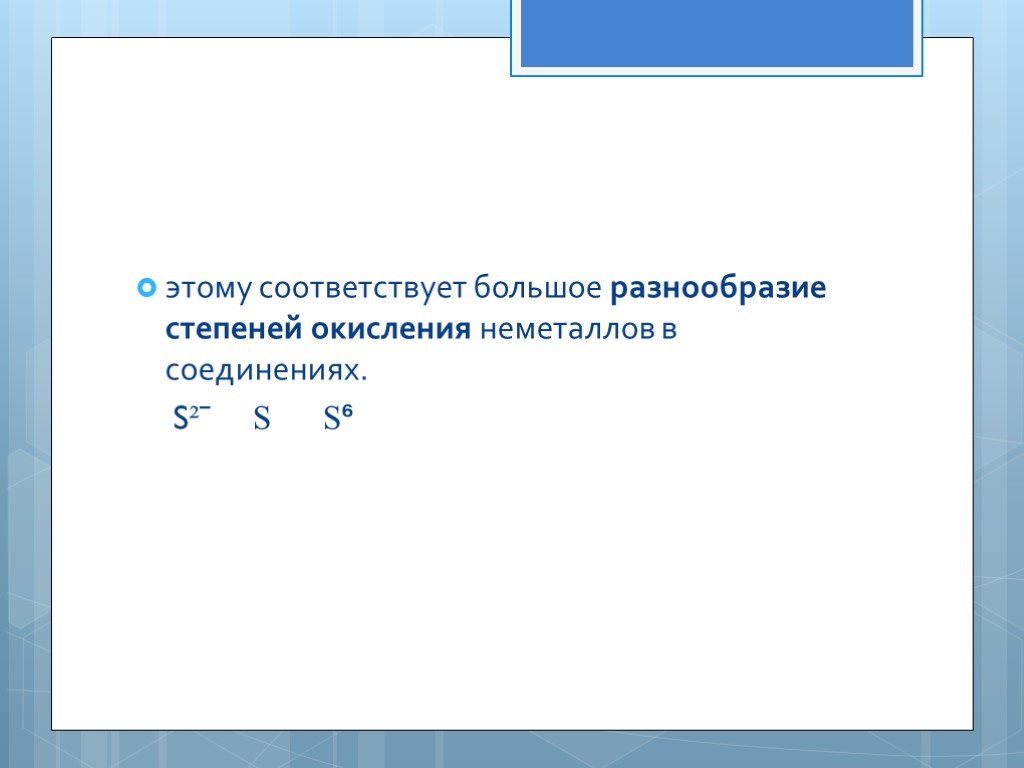
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Характеристика щелочных металлов
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна ...Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Закономерности изменения некоторых свойств химических элементов в ПС. 1. Положение элемента в ПС и строение его атома. ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА. ...Характеристика химических элементов и их соединений на основе положения элементов в периодической системе.
Цель урока? Химический элемент. Семейство Щелочные Ме Халькогены Период Группы Изотопы Валентность Д.И.Менделеев. Горячий стул. Химический диктант ...Характеристика нефти
Состав нефти. Элементный состав нефти (технический): мальтены (легкие фракции, растворяющиеся в петролейном эфире) асфальтены (растворимы в бензоле) ...Взаимодействие атомов элементов – неметаллов между собой
Что общего в составе частиц:. 1) 11H0, 21H0, 31H0 2) 168O0 , 168O2- , 178O0 3) 11H-, 21H-, 42He0. Разделите элементы на две группы: Cl, Mg, O, P, ...Химические свойства неметаллов
Цель. На этом уроке мы поведем разговор о простых веществах – неметаллах, их химических свойствах. Вы должны усвоить общие химические свойства неметаллов ...Характеристика элемента фосфор
Фосфор был открыт немецким алхимиком X. Брэндом в 1669 г. Позже А. Лавуазье доказал, что фосфор самостоятельный химический элемент. Ж. Пруст и М. ...Характеристика азота как химического элемента и простого вещества
Вслед за Резерфордом такие же опыты провели Шееле, Пристли и Кавендиш, которые называли исследуемое вещество «удушливым воздухом», «дурным воздухом». ...Примеры неметаллов
Цели и задачи урока. рассмотреть положение неметаллов в ПСХЭ Д.И.Менделеева и на основе строения атомов сделать вывод о физических и химических свойствах ...Положение металлов и неметаллов в периодической системе
Цель урока:. Изучить физические свойства металлов исследуя железо, алюминий, медь. Задачи урока:. 1.Изучить, на основе исследовательской работы с ...Неметаллы.Применение неметаллов
Неметаллы– это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. ...Неметаллы. Кислородные соединения неметаллов
Кислоты. Высшим оксидам неметаллов соответствуют следующие кислоты. . Кислородосодержащие кислоты являются гидроксидами кислотных оксидов. По основности ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Характеристика щелочных металлов
ПЛАН УРОКА. Строение атомов элементов главной подгруппы I группы. Щелочные металлы – простые вещества. Химические свойства щелочных металлов. Соединения ...Характеристика АХОВ и их поражающие факторы
Разработать классификацию АХОВ по характеру воздействия на человека. повторение. Какие вещества относятся к АХОВ? Химические вещества или соединения, ...Характеристика элемента - металла
Особенности элементов металлов. На внешнем уровне …. …Са + О2 =…СаО Металлы могут проявлять ….. свойства 3. Металлы проявляют общие физических свойства ...Характеристика высокомолекулярных соединений
Высокомолекулярными соединениями (ВМС) или полимерами. Природные полимеры. Синтетические полимеры. называются вещества, имеющие большую молекулярную ...Характеристика элементов VII группы главной подгруппы. Хлор
. . . . Нахождение в природе. В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только ...Характеристика железа
Сегодня на уроке мы с вами продолжаем изучать металлы. Какие металлы мы уже рассмотрели? Сегодня рассматриваем очень важный металл – основу современной ...Конспекты
Общая характеристика неметаллов
Тема урока «. Общая характеристика неметаллов. »,. 9 класс. Федотова Е. Г. учитель химии МБОУ СОШ №4 г. Южно-Сахалинск. Цель:. Используя антитезу ...Общая характеристика неметаллов
Конспект урока по химии. Тема урока: «Общая характеристика неметаллов». УМК:. Габриелян О.С. Химия 9 кл. Возраст: 9 класс. Учителя химии ...Общая характеристика металлов и неметаллов
П . лан- конспект урока "Общая характеристика металлов и неметаллов". . Девиз урока. : “Зажечь, увлечь и повести”. . Цели. В нетрадиционной ...Неметаллы. Общая характеристика неметаллов
. План-конспект урока химии в 9 -м классе с использованием ЦОР по теме: «Неметаллы. Общая характеристика неметаллов». Автор: Кобелева Вера Ивановна. ...Химические свойства неметаллов и их соединений. Кислотные дожди
Разработка урока «Химические свойства неметаллов и их. . соединений. Кислотные дожди» 9 класс. . учителя химии МБОУ ССОШ №13 Зимовниковского ...Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева
1001 идея интересного занятия с детьми. . ПРИМЕНЕНИЕ ТЕХНОЛОГИЙ КРИТИЧЕСКОГО МЫШЛЕНИЯ НА УРОКАХ ХИМИИИ. Бурдакова Кристина Олеговна, МБОУ СОШ ...Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Тема урока: Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева. Цельурока:. Расширить и углубить ...Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:27 октября 2018
Категория:Химия
Содержит:47 слайд(ов)
Поделись с друзьями:
Скачать презентацию