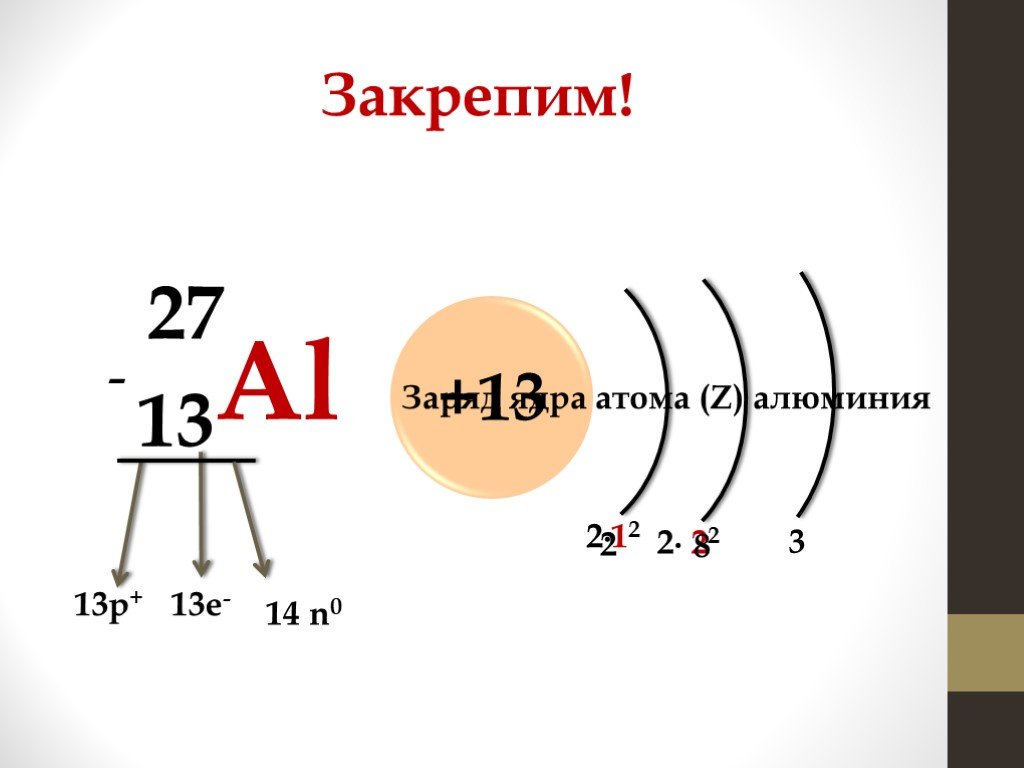
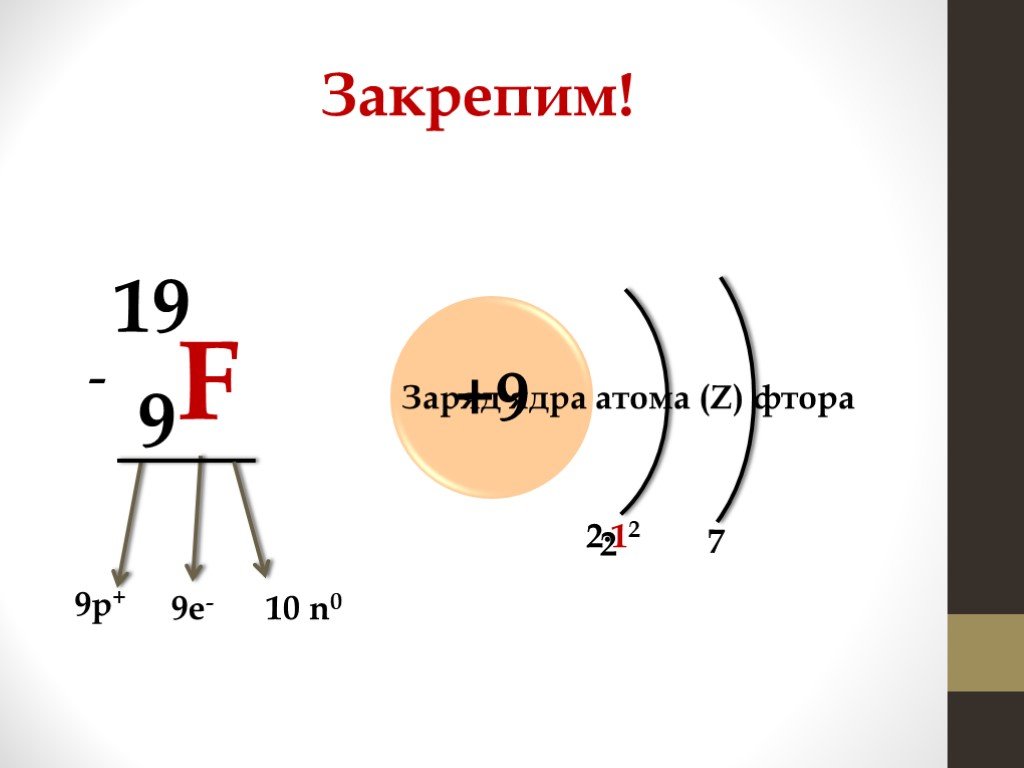
Презентация "Периодическая система химических элементов Д.И. Менделеева и строение атома" по химии – проект, доклад
Презентацию на тему "Периодическая система химических элементов Д.И. Менделеева и строение атома" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 31 слайд(ов).
Слайды презентации
Список похожих презентаций
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
ДЕВИЗ УРОКА:. Чтобы стать настоящим химиком, надо знать, уметь, думать!". ЭПИГРАФ УРОКА:. «… Другого ничего в природе нет, Ни здесь, ни там, в космических ...Периодическая система химических элементов Д.И. Менделеева
МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907). выдающийся русский деятель науки и культуры, автор фундаментальных исследований по химии, химической технологии, ...Периодическая система химических элементов Д.И. Менделеева
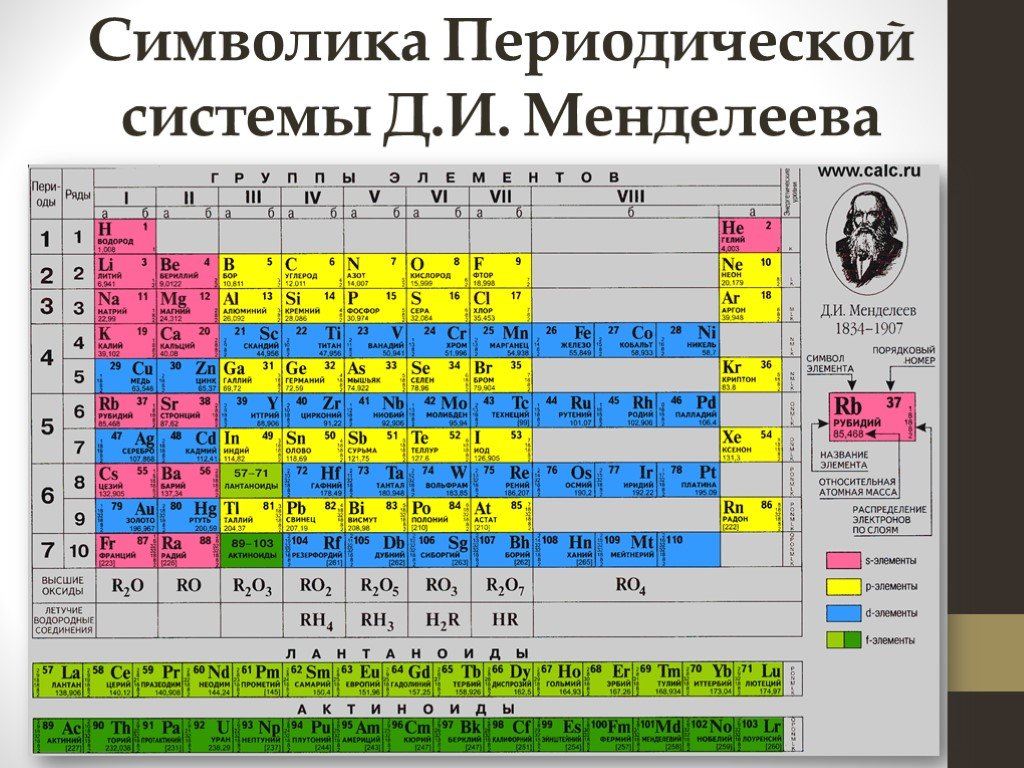
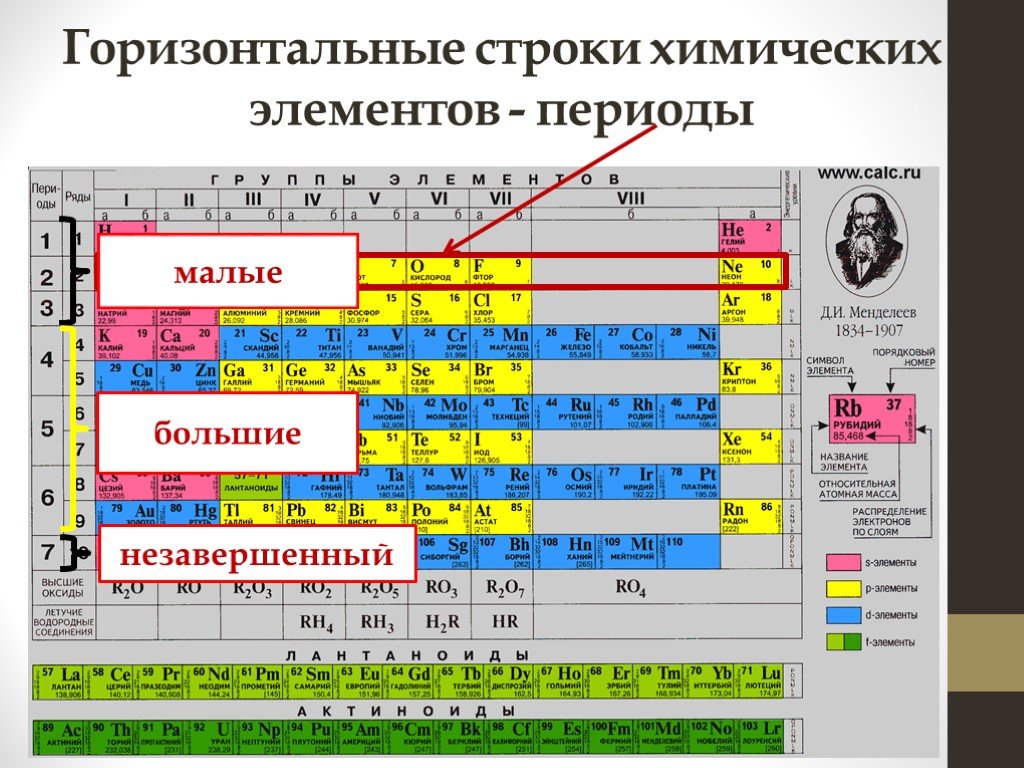
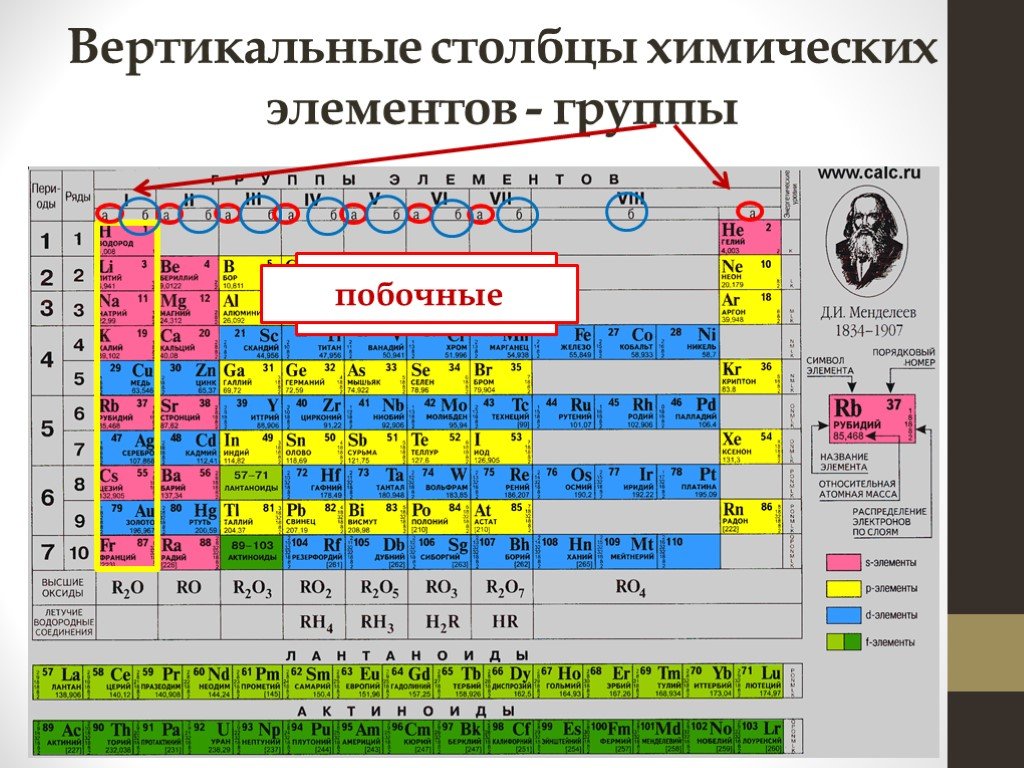
Цель. Сформировать представление о строении периодической системы Рассмотреть закономерности свойств химических элементов. Меню. Содержание. Историческая ...Периодический закон. Периоды Периодическая система химических элементов Д.И. Менделеева. Группы
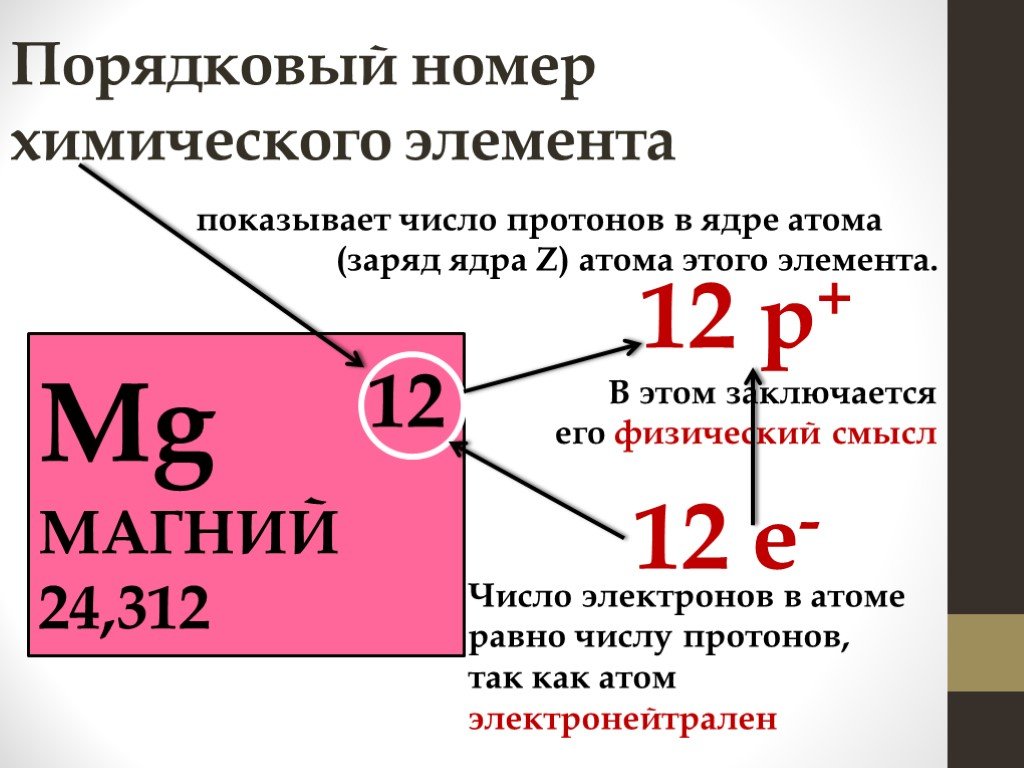
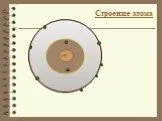
Периодический закон. Свойства химических элементов, а также образуемых ими простых и сложных веществ находится в периодической зависимости от относительных ...Строение атома и периодическая система химических элементов
Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3 n = 4. Энергетическая диаграмма АО для многоэлектронных атомов. Многоэлектронные атомы. 1s. Порядок заполнения ...Периодическая система Д.И.Менделеева
Д.И.Менделеев (1834 – 1907 г.). Мир сложен, Он полон событий, сомнений, И тайн бесконечных, и смелых догадок. Как чудо Природы является гений И в ...Периодическая система химических элементов
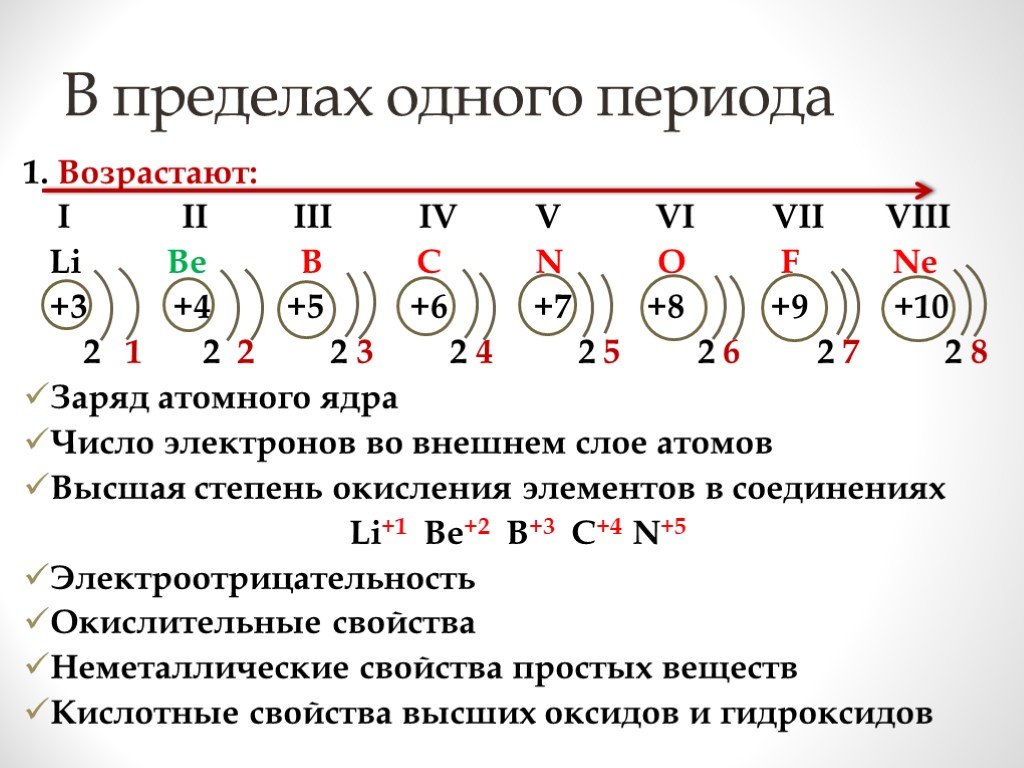
1. В главных подгруппах периодической системы химических элементов с увеличением заряда ядер не изменяется. Радиус атома; Число электронов на внешнем ...Периодическая система химических элементов в почтовых марках.
Границ научному познанию и предсказанию предвидеть невозможно. Д.И.Менделеев. Сюжетные изображения на почтовых марках отражают:. Свойства простых ...Строение атома и периодическая система
Какие открытия сделали ученые? 1. И.В. Деберейнер 2. А. Шанкуртуа 3. Л. Мейер 4. Д. Ньюлендс 5. М. Складовская - Кюри 6. А. Беккерель 7. Э. Резерфорд ...Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома
Родители атома. Демокрит (460 до н. э. — 370 до н. э.). Джозеф Джон Томсон (1856–1940 г). Эрнест Резерфорд (1871–1937г). Джеймс Чедвик (1891–1974г). ...Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева. Дмитрий Иванович Менделеев (1834-1907) – русский ученый-энциклопедист, талантливый химик, открывший периодический ...Таблица Менделеева и строение атома
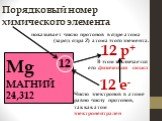
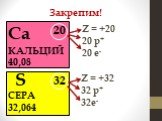
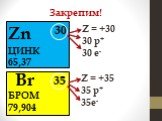
Элементы, атомы которых легко отдают ē для получения завершённого электронного уровня наз. металлами. Na + 11 8ē 1ē Mg ē. В. Что легче отдать 7ē или ..."Знаки химических элементов. Периодическая таблица
скисание молока, испарение воды, образование ржавчины, горение древесины, гашение соды уксусом, горение свечи, таянье льда, кипение воды, подгорание ...Периодическая таблица химических элементов
Тема урока: Классификация химических элементов. Начало классификации. К 70-м годам прошлого века было уже известно более 60 химических элементов. ...Периодическая система элементов
Попытки в систематике химических элементов (их было предпринято около 50). Триады И. Деберейнера (1829г.) Триада- тройка сходных элементов . Из известных ...Периодический закон и периодическая система элементов
Периодический закон и периодическая система элементов. В 1869 г. Дмитрий Иванович Менделеев показал, что свойства простых веществ, а также формы и ...Строение периодической таблицы Д.И. Менделеева
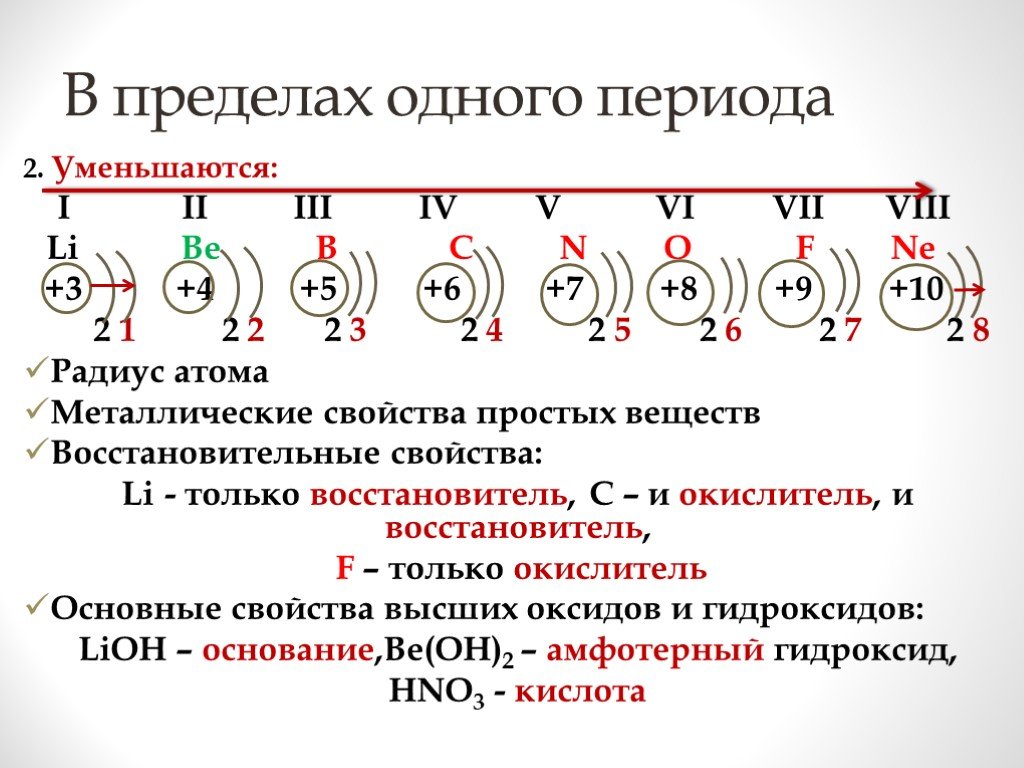
Металлы Неметаллы. Металлические свойства усиливаются, а неметаллические ослабевают; Увеличиваются заряды атомных ядер; Постоянно число электронов ...Неорганические соединения. Периодическая таблица Д.И.Менделеева
Урок-конкурс по теме: «Неорганические соединения. Периодическая таблица Д.И.Менделеева». Цель: Закрепить полученные знания по основным классам неорганической ...Конспекты
Периодическая система химических элементов Д.И.Менделеева и строение атома
Тема:. Повторение и обобщение знаний по теме: «Периодическая система химических элементов Д.И.Менделеева и строение атома». Цель:. . повторить ...Периодический закон и периодическая система химических элементов Д.И.Менделеева
Кокалажарская средняя школа. Урок обобщения и систематизации знаний по теме. «Периодический закон и периодическая система химических ...Периодический закон и периодическая система химических элементов Д.И.Менделеева
Разработка урока химии. в 8 классе. по теме. . «Периодический закон и. . периодическая система химических элементов. . Д.И.Менделеева». ...Периодический закон и периодическая система химических элементов Д.И. Менделеева
Муниципальное бюджетное образовательное учреждение. Александровская средняя общеобразовательная школа. Методическая разработка:. Обобщающий ...Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
План урока №5. . Тема:. Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов. Цель:. Закрепить знание о том, ...Периодический закон и периодическая система химических элементов Д.И. Менднлеева. Группы и периоды
План-конспект урока химии (8 класс) по теме: "Периодический закон и периодическая система химических элементов Д.И. Менднлеева. Группы и периоды.". ...Периодический закон и периодическая система химических элементов Д. И. Менделеева
Тесник Юлия Валерьевна. учитель химии. . МБОУ “Средняя общеобразовательная школа №26” г. Калуги. Урок по химии в 8 классе. . “Периодический ...Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Периодический закон и Периодическая система элементов Д. И. Менделеева. Строение вещества (ПОВТОРЕНИЕ)
Дата ______________ Класс_______________. Тема:. Периодический закон и Периодическая система элементов Д. И. Менделеева. Строение вещества (ПОВТОРЕНИЕ). ...Состав и строение атома. Классификация химических элементов
Урок 8кл. Тема: Состав и строение атома. Классификация химических элементов. Цель: Формировать знания о строении атома, умения определять величину ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 октября 2018
Категория:Химия
Содержит:31 слайд(ов)
Поделись с друзьями:
Скачать презентацию