Презентация "Химические уравнения. Реакции обмена" по химии – проект, доклад
Презентацию на тему "Химические уравнения. Реакции обмена" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Реакции ионного обмена. Ионные уравнения
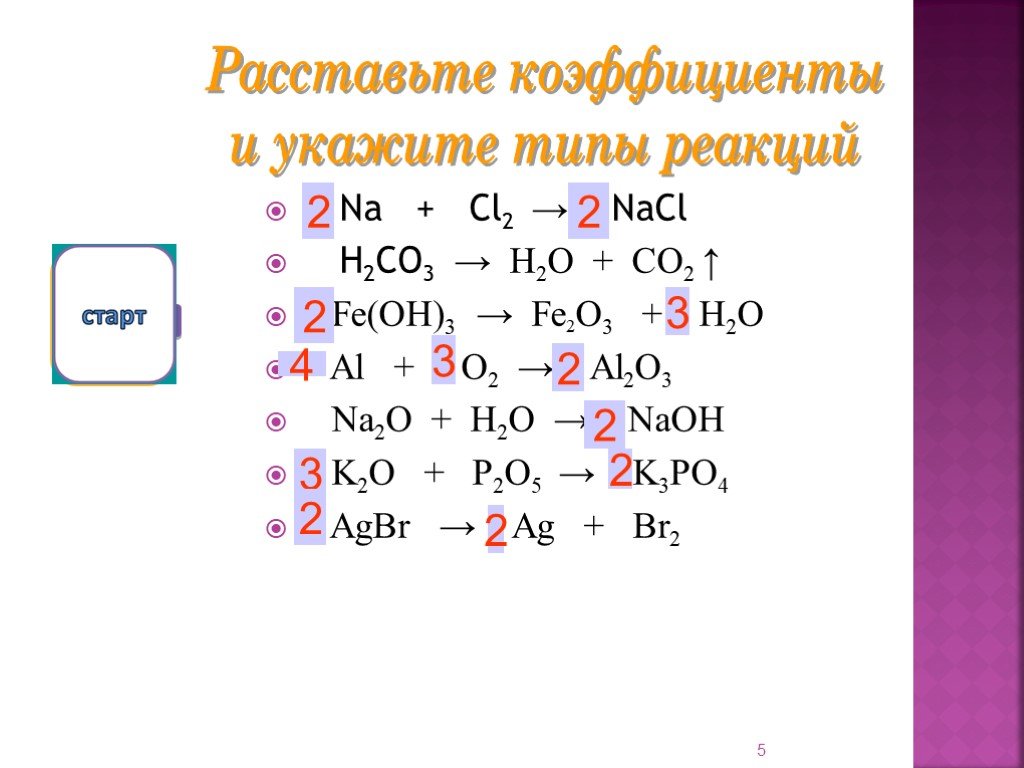
Определите тип данной реакции по числу и составу веществ вступивших и образующихся в реакции AqNO3 + HCl = AqCl + HNO3. реакция обмена. Технологическая ...Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Ионные реакции – реакции протекающие между ионами в растворе. Порядок составления ионных уравнений реакции. 1. Записывают молекулярное уравнение реакции ...Химические реакции
Разминка. НСl Н2SО4 НNО3 Н3РО4 СаСl2 Н2SiО3 Мg(NO3)2 НI К3РО4 НNO2 Cu(OH)2. Серная кислота Соляная кислота Азотная кислота. Ортофосфорная кислота. ..."Реакции ионного обмена"
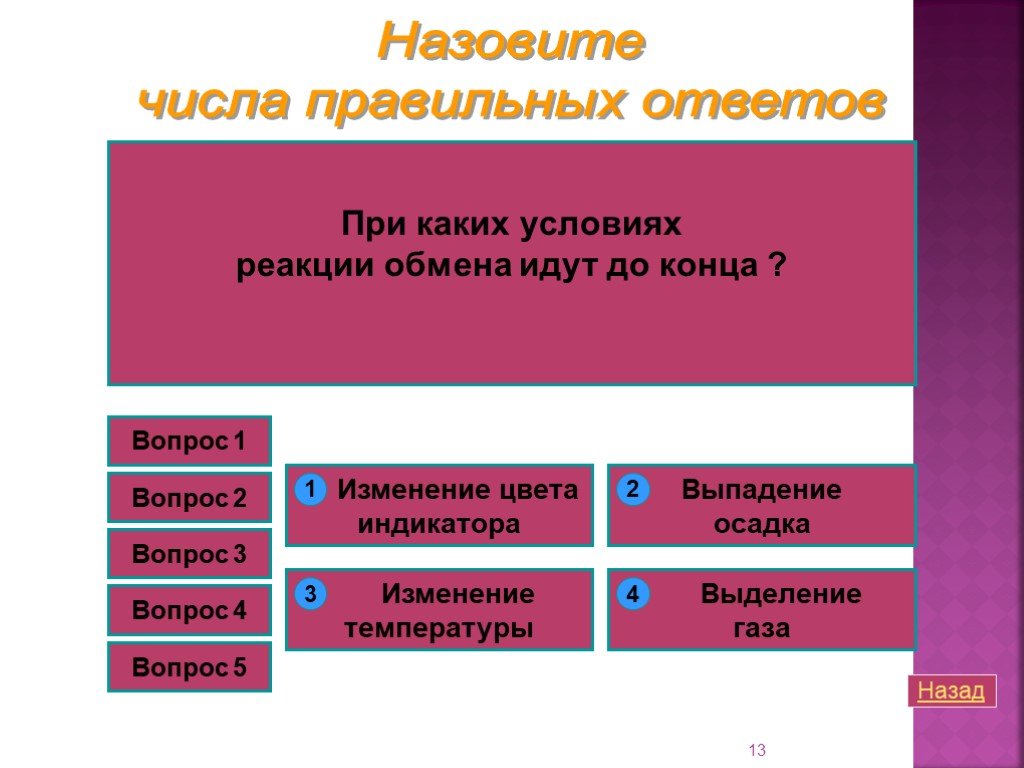
Реакции обмена протекают между ионами, поэтому они называются реакциями ионного обмена Реакции ионного обмена идут до конца в трех случаях. Если образуется ...Химические реакции
Цели 1. Образовательная: Повторить основные свойства веществ. Повторить основные типы химических реакций. 2. Развивающая: Продолжать развитие наблюдательности ...Химические реакции
Аннотация. Данная презентация может быть использована при изучении химии на 1 курсе по программе НПО по при изучении темы «Химические реакции». В ...Химические реакции. Мир химии
Признаки химической реакции! 1 Выделение газа. 2 Выделение теплоты. 3 Образование осадка. 4 Изменение цвета. 5 Выделение запаха. Реакции! Химическая ...Химические реакции
Химические реакции. Химический диктант. 1.почернение медной пластинки при нагревании, 2.плавление металла 3.Кипение воды 4.выделение пузырьков газа ...Химические реакции. Составление уравнений химических реакций
Цели и ожидаемые результаты. Повторить понятия как простые и сложные вещества, составление химической формулы вещества, химические реакции. Научиться ...Химические реакции в органической химии
Тест Напиши формулы углеводородов:. 1. Бутан 6. Метан 2. Этан 7. Гексан 3. Нонан 8. Декан 4. Гептан 9. Октан 5. Пропан 10. Пентан. Реакции горения:. ...Химические реакции и явления, которые их сопровождают
Растет дерево Замерзает вода Ржавеет металл. Растворяется сахар в чае. Извергается вулкан. Скисает молоко. Тема урока: Физические и химические явления. ...Химические реакции
Типы химических реакций. По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению степени окисления По агрегатному состоянию ...Физические и химические явления. Химические уравнения
Содержание. 1. Химические и физические явления 2. Признаки протекания химических реакций 3. Условия протекания химических реакций 4. Закон сохранения ...Химические реакции
План урока. 1. Физические и химические явления. 2. Признаки химических реакций. 3. Условия протекания реакций. 4. Значение химических реакций. Как ...Применение ацетилена. Химические реакции, лежащие в основе применения
Химические реакции, лежащие в основе применения ацетилена. Реакции получения и горения ацетилена CaC2 + 2H2O → Ca(OH)2 + C2H2 2C2H2 + 5O2 → 4CO2 +2H2O ...Реакции ионного обмена
ЦЕЛЬ урока: сформировать понятие о реакциях ионного обмена. ЗАДАЧИ: Образовательные: познакомить учащихся с реакциями ионного обмена и условиями их ...Уравнения реакций ионного обмена
Реакции ионного обмена-. это реакции в водных растворах электролитов между ионами. Уравнения. реакций ионного обмена называют ионными уравнениями. ...Реакции ионного обмена
Ошибка. Убери лишнее. (Найдите неэлектролиты). NaOH NaCl K2SO4 H2SO4 CaCO3 Mg(NO3)2 CuCl2 BaSO4 CaSO4 Cu(OH)2 SО3 FeCl3 NaNO3 Ca(OH)2 Al(NO3)3 Na2CO3. ...Реакции ионного обмена
Получение гидроксида меди (II). I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2 + Ba(OH)2 = Cu(OH)2 + BaBr2 3 группа: Cu(NO3)2 + 2NaOH = Cu(OH)2 ...Химические реакции
Оглавление:. ВВЕДЕНИЕ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: По числу и составу реагирующих веществ По изменению степеней окисления химических элементов ...Конспекты
Химические реакции. Электролиз
ПЛАН-КОНСПЕКТ УРОКА Тема урока. : Электролиз. . ФИО. . . Хубиева Людмила Руслановна. . . . Место работы. . МБОУ СОШ ...Химические уравнения. Составление химических уравнений
ПЛАН-КОНСПЕКТ УРОКА «Химические уравнения. Составление химических уравнений». (Тема урока). . ФИО (полностью). . Кротова Светлана Викторовна. ...Химические реакции
«Химическое путешествие. Обобщение знаний учащихся по теме «Химические реакции»». Задачи урока. Образовательные:. повторить и обобщить знания ...Химические реакции. Признаки химических реакций
Тема: Химические реакции. Признаки химических реакций. Тип урока. : изучение нового материала и первичного закрепления знаний. Вид урока. : ...Химические реакции
Министерство общего и профессионального образования Свердловской области. Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная ...Химические реакции
8 класс. Урок по теме «Химические реакции». Цель:. обобщить и систематизировать знания по теме «Химические реакции». Задачи: 1) образовательная:. ...Реакции обмена
МБОУ Ясенецкая СОШ. Павловский район. Нижегородская область. . Конспект урока. . Предмет : химия. Программа :. . О.С. Габриелян « ...Реакции обмена
Ф.И.О. автора. –. Желовникова Оксана Викторовна. . . Место работы - ГБОУ СОШ п. Комсомольский м.р. Кинельский Самарской области. Должность- ...Реакции обмена
Урок химии, 8 класс (базовый уровень). Учитель : Серебрякова Елена Васильевна. МОУ СОШ № 9,г.Георгиевска. Тема урока: Реакции обмена. Задачи:. ...Реакции ионного обмена и условия их протекания
Дата ______________ Класс_______________. Тема: Реакции ионного обмена и условия их протекания. Цели урока:. познакомить учащихся с ионными уравнениями ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 мая 2019
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию