Презентация "Одноатомные спирты" по химии – проект, доклад
Презентацию на тему "Одноатомные спирты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Одноатомные спирты
Цели и задачи :. узнать о представителях класса спиртов, их классификации изучить изомерию и номенклатуру класса. Научиться решать тестовые задания ...Одноатомные спирты. Состав. Строение. Свойства.
Цель урока:. Дать учащимся первоначальные понятия о кислородсодержащих веществах. Познакомить с составом и строением одноатомных спиртов, дать понятие ...Одноатомные спирты
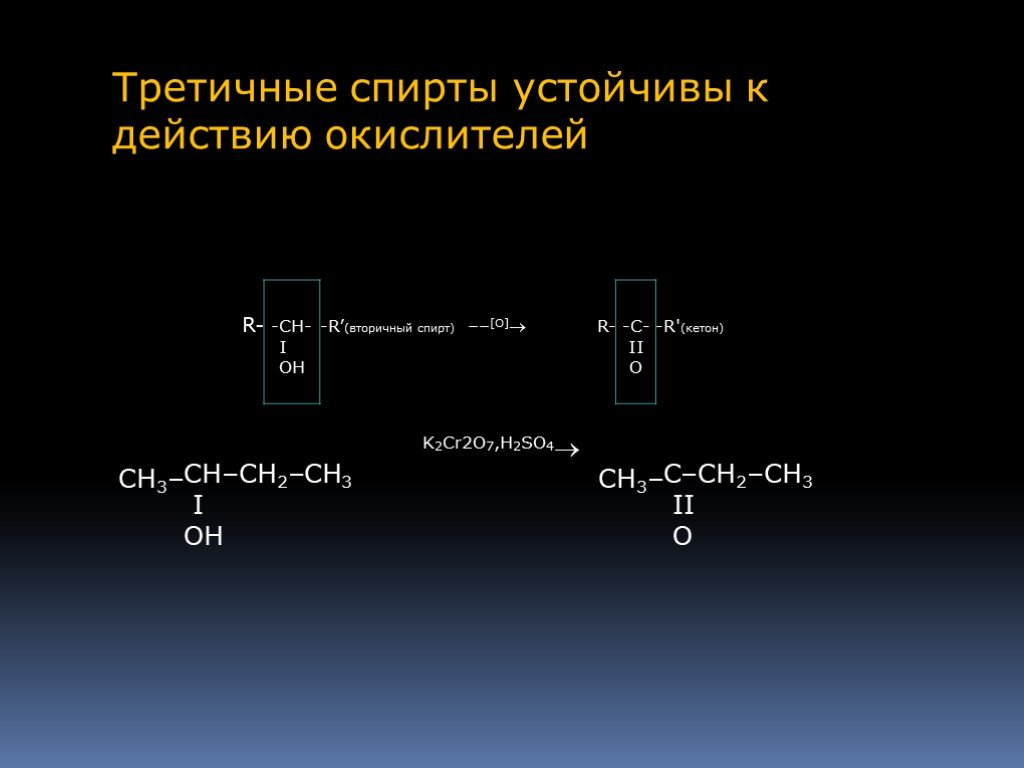
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп. По их числу спирты подразделяются на одноатомные, двухатомные, ...Предельные одноатомные спирты
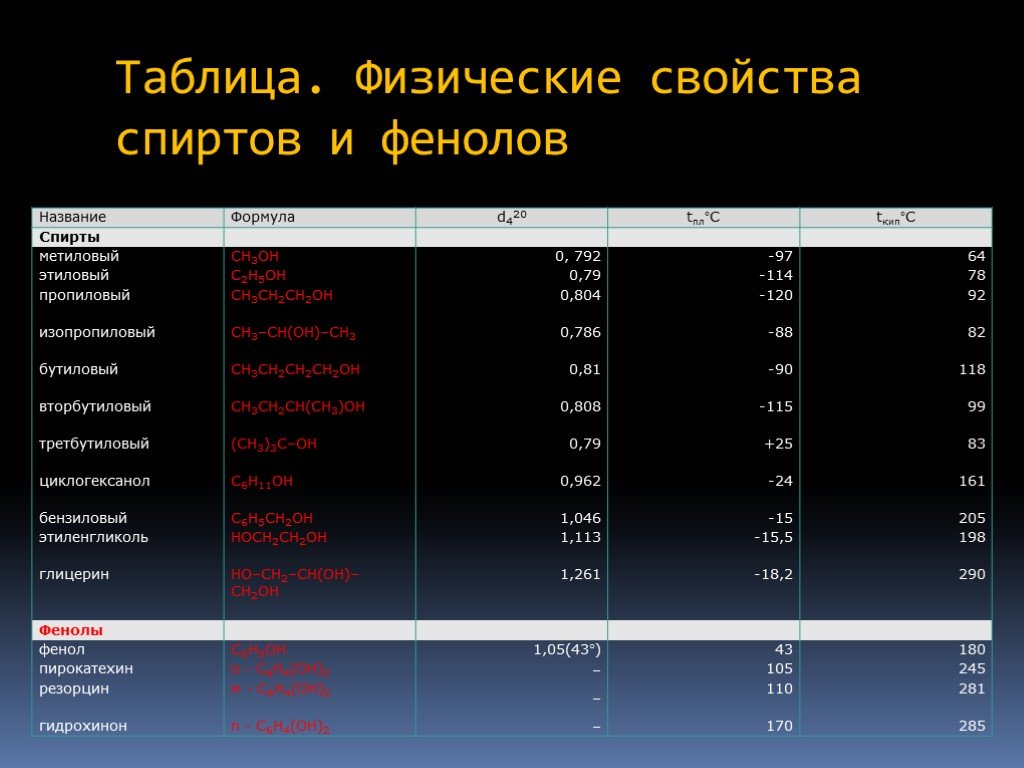
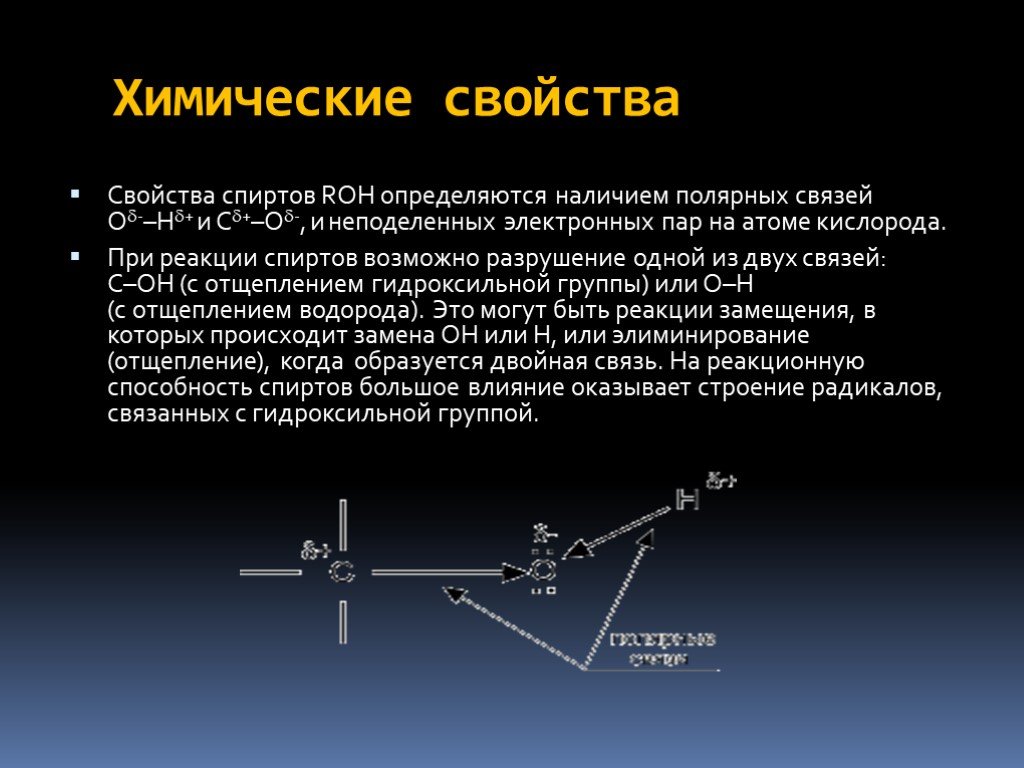
Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Аномалии у спиртов Химические свойства Физиологическое действие ...Спирты. Предельные одноатомные спирты
Общая характеристика. Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при каком углеродном атоме ...Алканолы - Предельные одноатомные спирты
Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Аномалии у спиртов Химические свойства Физиологическое действие ...Многоатомные спирты кратко
Многоатомные спирты (полиспирты, полиолы) — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Фенолы ...Многоатомные спирты
Термин. Представители многоатомных спиртов — этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы—ОН, называются гликолями, ...Многоатомные спирты
Вопросы для повторения. Какими способами может быть получен этиловый спирт? Назовите условия промышленного процесса гидратации этилена и дайте им ...Многоатомные спирты
Многоатомные спирты. Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных ...Многоатомные спирты
Цель урока:. Познакомить учащихся со строением, физическими и химическими свойствами многоатомных спиртов,значением и применением их в промышленности ...Многоатомные спирты
Многоатомные спирты — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Особое значение многоатомные ...Многоатомные спирты
Многоатомные спирты - это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов. Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Конспекты
Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. Применение
Дата_____________ Класс_______________. Тема:. Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. ...Одноатомные спирты
Урок:. . Тема: Одноатомные спирты. Цели урока:. 1.Дать учащимся первоначальные понятия о кислородсодержащих. . веществах. Познакомить с составом ...Одноатомные спирты
11 класс. Тема урока:. «Одноатомные спирты». Цель урока:. ознакомление учащихся с новым классом органических соединений – спиртами. Задачи:. ...Одноатомные спирты
Автор:. Красильникова Наталья Александровна. Полное название образовательного учреждения:. Муниципальное общеобразовательное учреждение Шарловская ...Спирты. Предельные одноатомные спирты
Муниципальное бюджетное образовательное учреждение. «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 3». . . . Конспект урока по химии. в 10 классе. ...Предельные одноатомные спирты
МОУ «Мочалищенская СОШ». Конспект урока для учащихся 10 класса по теме «Предельные одноатомные спирты». ТЕМА:. «Влияние алкоголя на состояние здоровья ...Предельные одноатомные спирты
Технологическая карта урока. Предмет Химия__________________________________________________________. Класс__10__(1 час)__________________________________________________________. ...Предельные одноатомные спирты
Технологическая карта урока. Учитель: Валуева В.В. Предмет химия. Класс 10. Автор УМК О.С.Габриелян. Тема урока Предельные одноатомные спирты. ...Кислородсодержащие органические соединения. Предельные одноатомные спирты
Государственное общеобразовательное учреждение -. средняя общеобразовательная школа. при Посольстве России в Турции. Конспект урока по химии ...Многоатомные спирты
. . Тема: «Многоатомные спирты». Тип методического пособия –. методическая разработка урока. Предмет:. химия. 1. Цели:. Сформировать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 февраля 2019
Категория:Химия
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию





















![Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C ––2[H] СH3–CH2CH2–OH I H СH3-- C --CH3 ––2[H] CH3--CH--СH3 II I O OH Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C ––2[H] СH3–CH2CH2–OH I H СH3-- C --CH3 ––2[H] CH3--CH--СH3 II I O OH](https://prezentacii.org/upload/cloud/19/02/128769/images/thumbs/screen8.jpg)