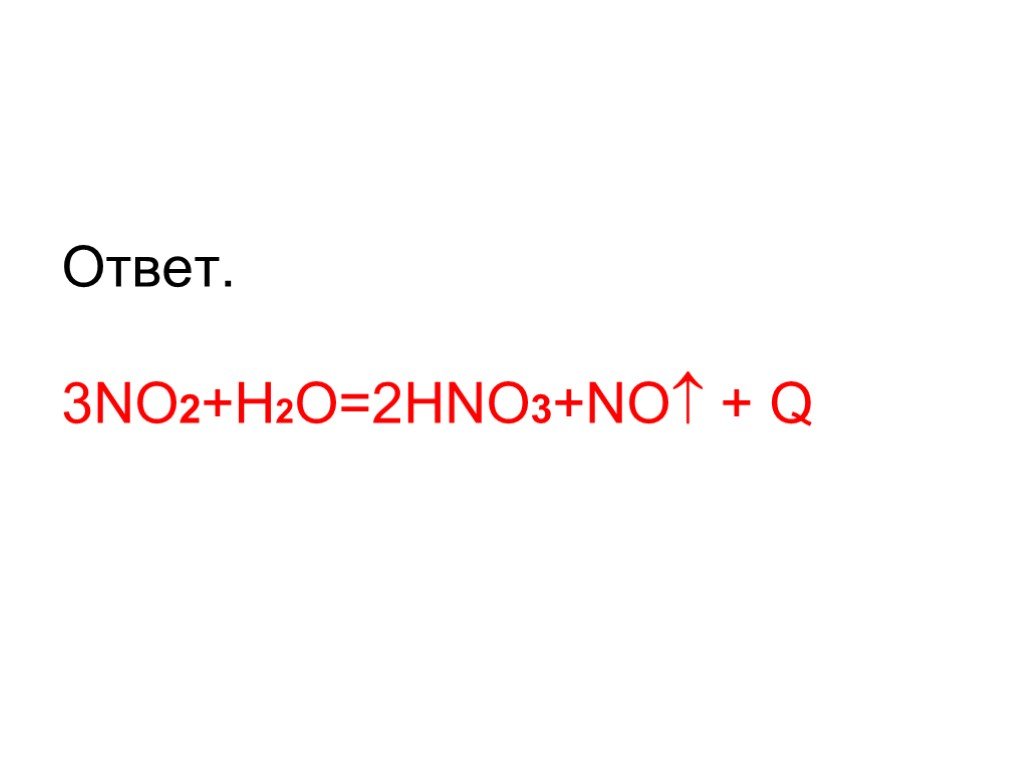Презентация "«Неметаллы» (Подгруппа азота)" по химии – проект, доклад
Презентацию на тему "«Неметаллы» (Подгруппа азота)" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 36 слайд(ов).
Слайды презентации
Список похожих презентаций
Подгруппа азота
Выбери игру. Управление презентацией. 1. Главный слайд - № 2 (по гиперссылке необходимо перейти на любую из игр). На главный слайд (№ 2). Завершить ...Подгруппа азота (V - А группа)
N P As Sb Bi - азот - фосфор. - мышьяк ( арсеникум). - сурьма (стибиум) - висмут. Чем похожи и чем различаются элементы главной подгруппы V группы? ...Подгруппа азота. История открытия элементов
Четырежды открытый. Генри Кавендиш (1732 – 1810). Джозеф Пристли (1733 – 1804). Карл Шееле (1742-1786). Даниель Резерфорд (1749 – 1819). Британский ...Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Подгруппа азота
1.С ростом порядкового номера элемента кислотные свойства оксидов в ряду…. N2O - P2O3 - As2O3 - Sb2O3 -Bi2O3. а) усиливаются б) ослабевают в) остаются ...Подгруппа углерода
Цель урока:. Выяснить насколько усвоен материал по теме, дополнить знания учащихся об оксидах углерода и кремния и других соединениях. Совершенствовать ...Подгруппа углерода
Химия. Подгруппа углерода. Положение элементов подгруппы углерода в периодической системе, строение их атомов. C, Si, Ge, Sn, Pb. Общая характеристика. ...Подгруппа углерода
Загадка: Из меня состоит все живое: Я – графит, антрацит и алмаз, Я на улице, в школе и в поле, Я в деревьях и в каждом из вас. Работа с учебником ...Подгруппа Селена
В подгруппе селена, как и в других подгруппах р-элементов, с увеличением размеров атомов наблюдается общая тенденция к увеличению характерного координационного ...Подгруппа кислорода
Реактивы: сульфат натрия, сульфат меди (ll), лакмус, фенолфталеин, хлорид бария, гидроксид калия, серная кислота Оборудование: набор пробирок (ПХ-14, ...Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Формулы оксида азота
Что относится к кислородным соединениям? Оксиды Кислоты (кислородсодержащие). Оксиды азота и кислоты, содержащие азот. Оксиды азота. Степени окисления ...Оксиды азота
Оксиды азота. Физические свойства, токсичность, методы получения. ФИЗИЧЕСКИЕ СВОЙСТВ ОКСИДОВ АЗОТА. Оксид азота (I), закись азота, «веселящий газ». ...Оксиды азота
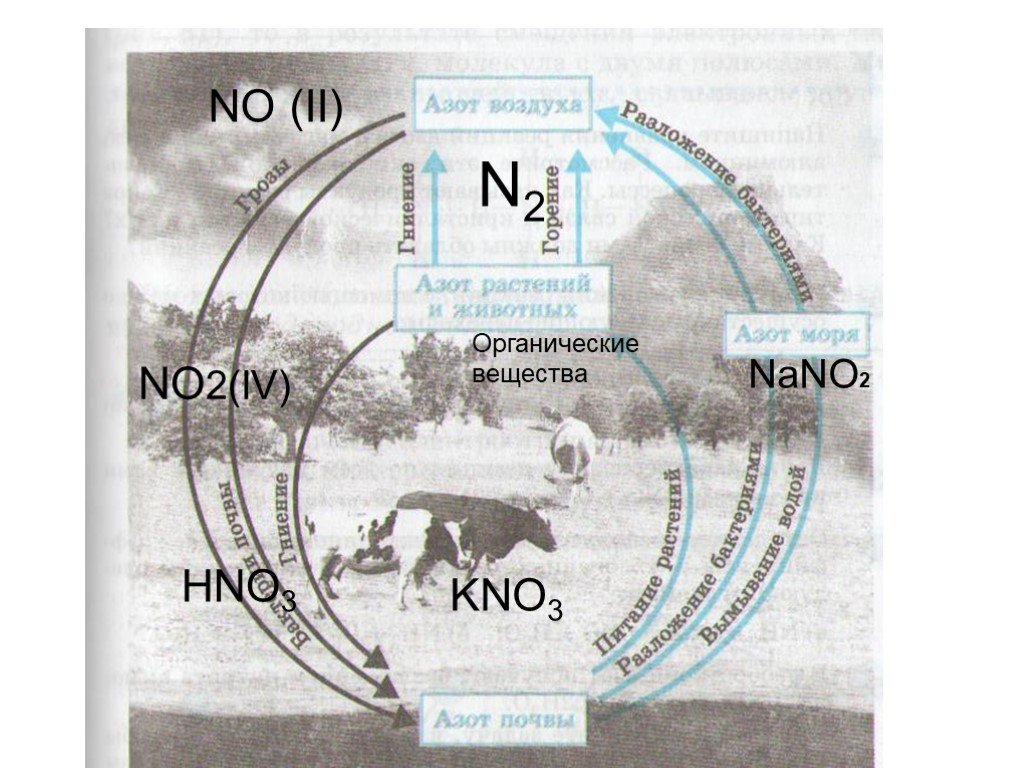
Содержание. Виды оксидов азота. Оксид азота(I). Оксид азота(II). Оксид азота(III). Оксид азота(IV). Азотный ангидрид. Виды оксидов азота. N2O NO N2O3 ...Круговорот азота в природе
Круговорот азота представляет собой ряд замкнутых взаимосвязанных путей, по которым азот циркулирует в земной биосфере. Различные микроорганизмы извлекают ...Круговорот азота
Цель: Изучить биохимические процессы круговорота азота в природе; Узнать, что такое круговорот азота; Задачи: Что такое азот? Что такое Круговорот ...Задачи Подгруппа кислорода
Практическая работа№2 Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: опытным путем определить растворы следующих веществ: H2SO4 ...Соединения азота
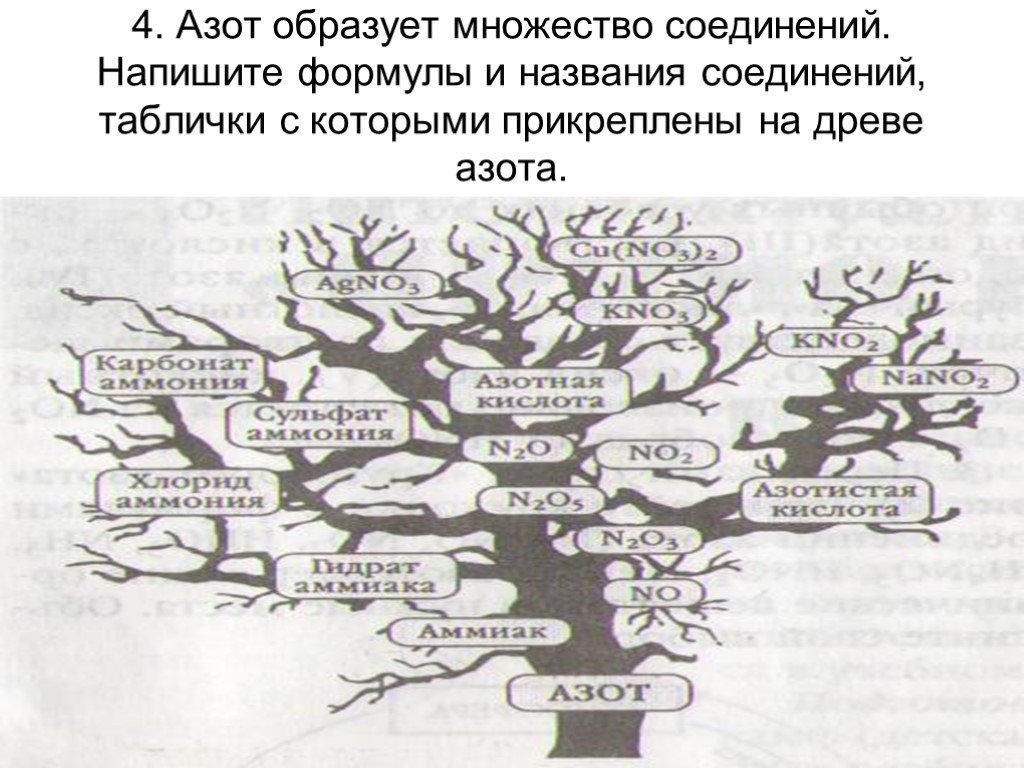
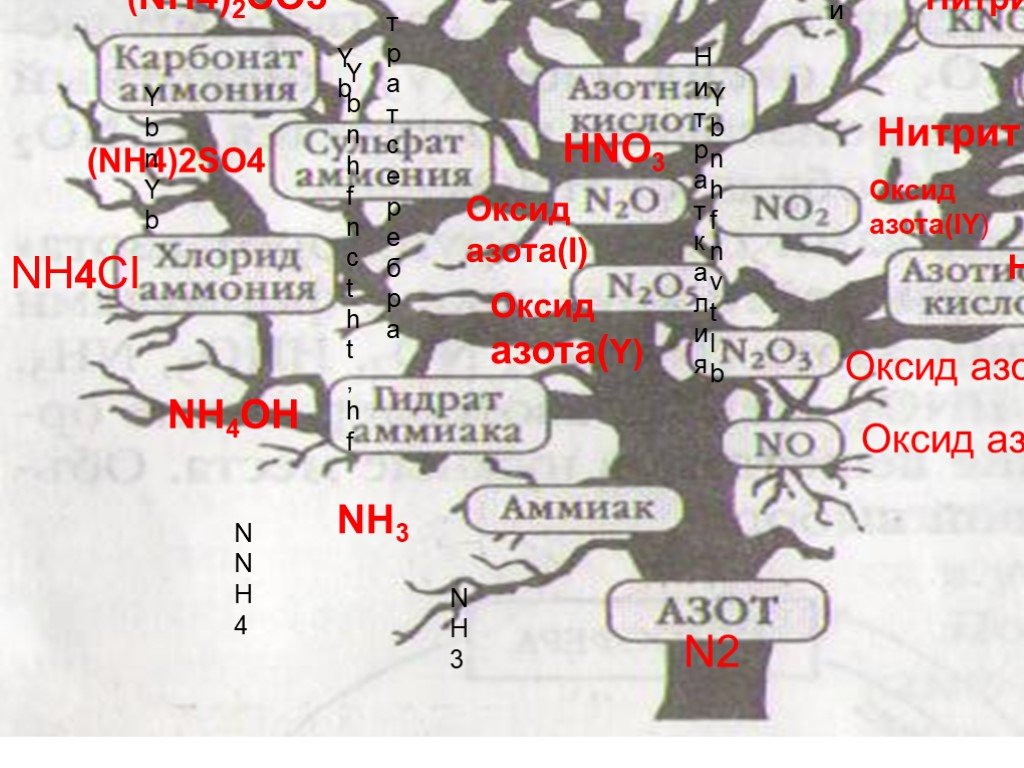
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова:. Получение ...Кислородные соединения азота
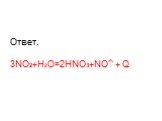
Оксиды азота:. . Вещества, образующиеся из оксидов азота:. N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 + H2O = HNO3+ HNO2 N2+5O5-2 ...Характеристика азота как химического элемента и простого вещества
Вслед за Резерфордом такие же опыты провели Шееле, Пристли и Кавендиш, которые называли исследуемое вещество «удушливым воздухом», «дурным воздухом». ...Конспекты
Подгруппа азота
Урок-семинар в 9 классе. по теме: «Подгруппа азота». Девиз урока: « Мало знать, надо и применять. Мало хотеть, надо и делать» (Гёте). Цели ...Подгруппа азота
АЗОТ. Тема. : подгруппа азота. Тема урок. : азот. Цели. . . . 1. . Образовательная. . Выявление и оценка степени овладения учащимися системой ...Подгруппа Азота
Итоговый урок по теме: « Подгруппа Азота» . ( урок для учащихся 9 классов по неорганической химии, изучаемый в разделе «Подгруппа азота» на который ...Подгруппа азота
Конспект урока по химии в 9 классе. Гребенюк Татьяна Николаевна,. . . учитель химии высшей категории. МОУ СОШ №5 «Образовательный центр». ...Соли аммония. Оксиды азота (II) и (IV)
Урок 20. Соли аммония. Оксиды азота (II) и (IV). Цели урока:. 1. Охарактеризовать соли аммония и оксиды азота (II) и (IV) по следующей схеме: ...Соединения азота
Урок химии в 9 классе по теме: «Соединения азота». Составитель урока. : учитель химии МОУ СОШ № 2 Нытвенского района Пермского края Ощепкова Ирина ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Подгруппа кислорода
Дата_____________ Класс_______________. Тема:. . Практическая работа №2 Решение экспериментальных задач по теме «Подгруппа кислорода». Цели урока:. ...Подгруппа кислорода
Урока по химии 9 класс по теме:. «Подгруппа кислорода». Составлен учителем химии. МОУ «СОШ №5 г.Кировска». Зудковой Верой Сергеевной. Цель ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 февраля 2019
Категория:Химия
Содержит:36 слайд(ов)
Поделись с друзьями:
Скачать презентацию