Презентация "Кинетика химических реакций.Химическое равновесие" по химии – проект, доклад
Презентацию на тему "Кинетика химических реакций.Химическое равновесие" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 28 слайд(ов).
Слайды презентации
Список похожих презентаций
Обратимость химических реакций. Химическое равновесие
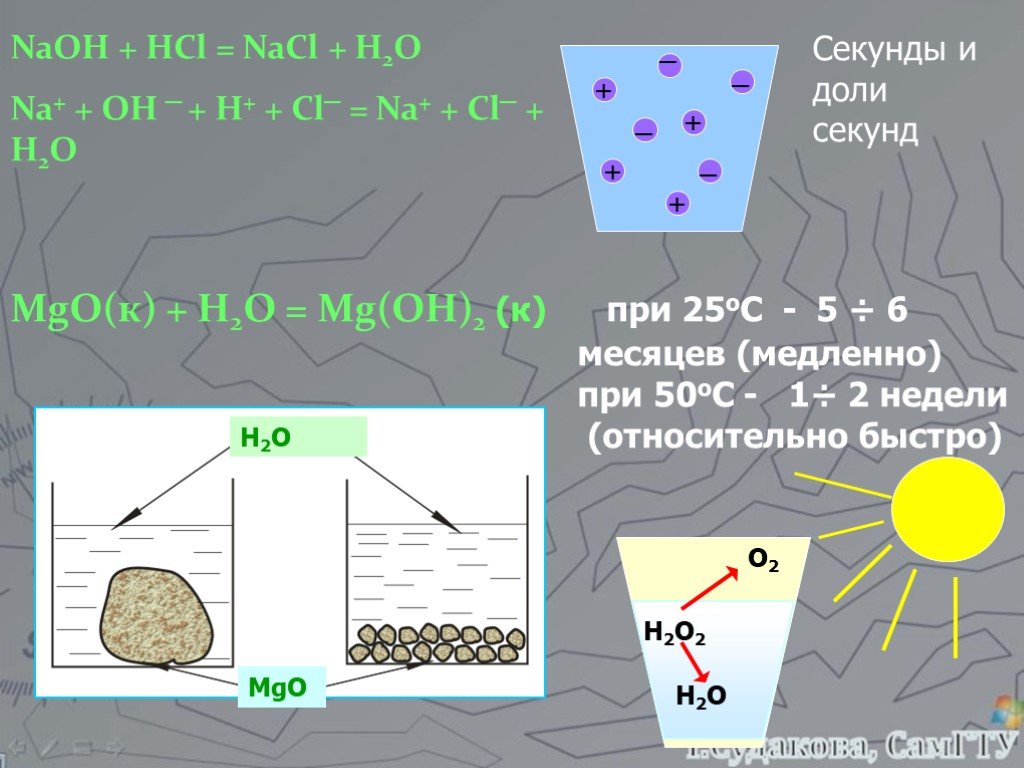
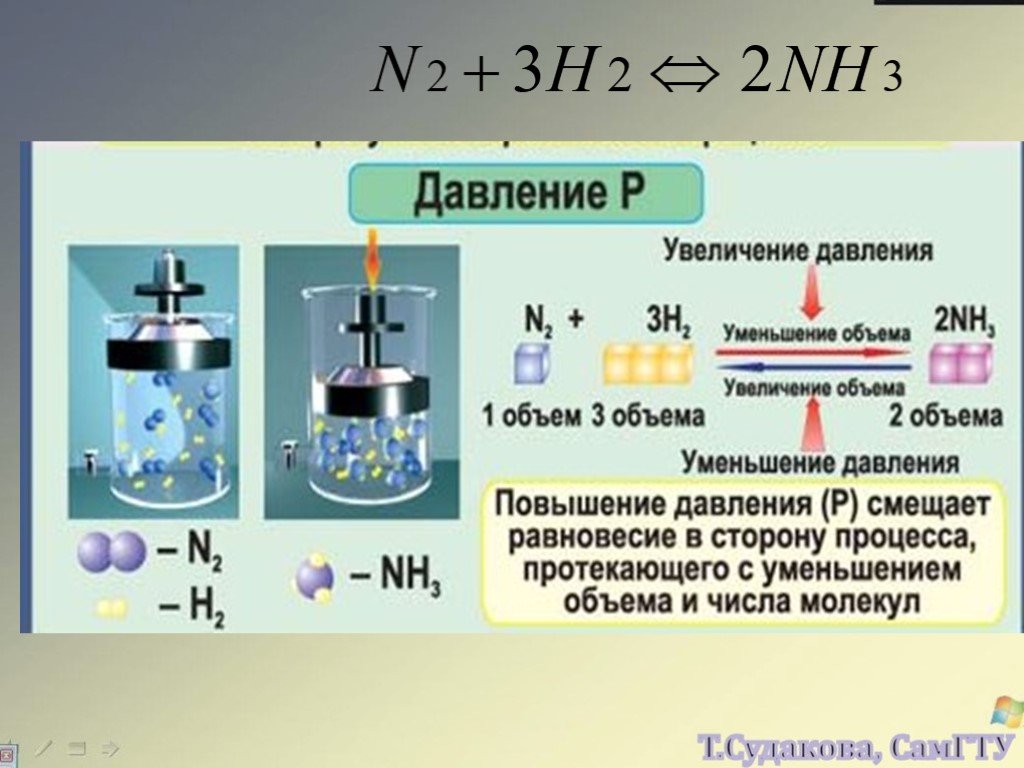
Какие из химических реакций являются обратимыми? 1. NaOH + HCl NaCl + H2O 2. N2 + 3H2 2NH3 3. AgNO3 + NaCl AgCl + NaNO3 4. SO3 + H2O H2SO4 ...Составление уравнений химических реакций
Научится составлять уравнения химических реакций. Пример. Пример: Составить уравнение реакции взаимодействия фосфора и кислорода. =. 1. В левой части ...Скорость химической реакции. Факторы влияющие на скорость химических реакций
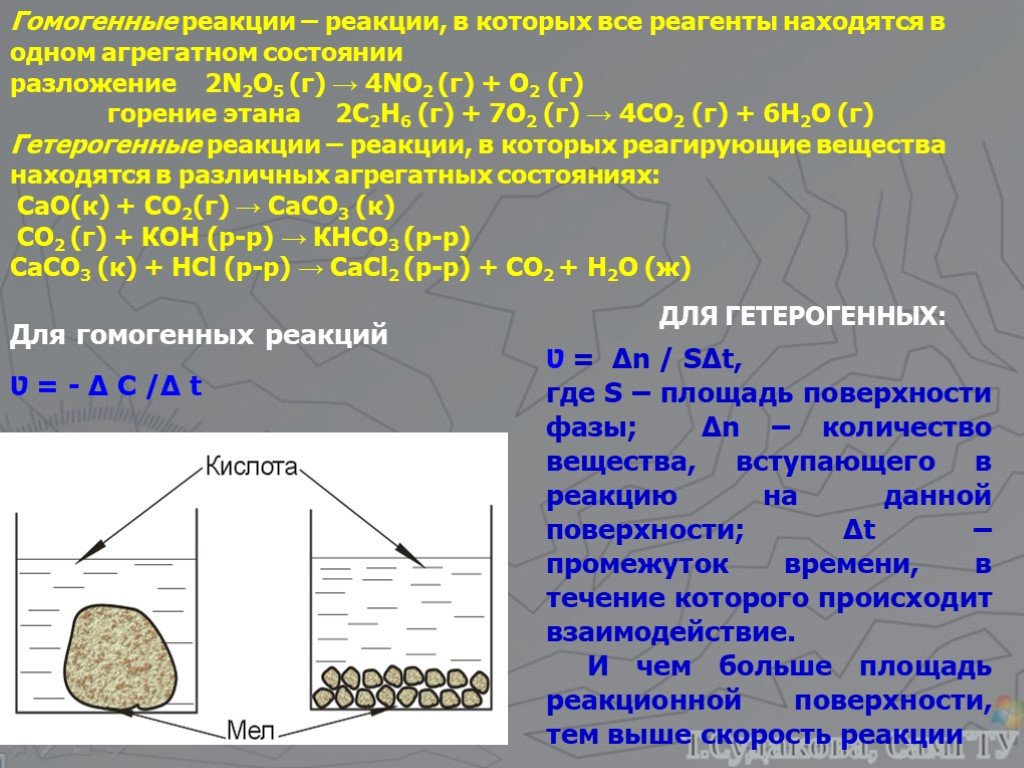
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ (АГРЕГАТНОЕ СОСТОЯНИЕ). ХИМИЧЕСКИЕ РЕАКЦИИ. ГОМОГЕННЫЕ ГЕТЕРОГЕННЫЕ. (реагирующие вещества и ...Скорость химических реакций
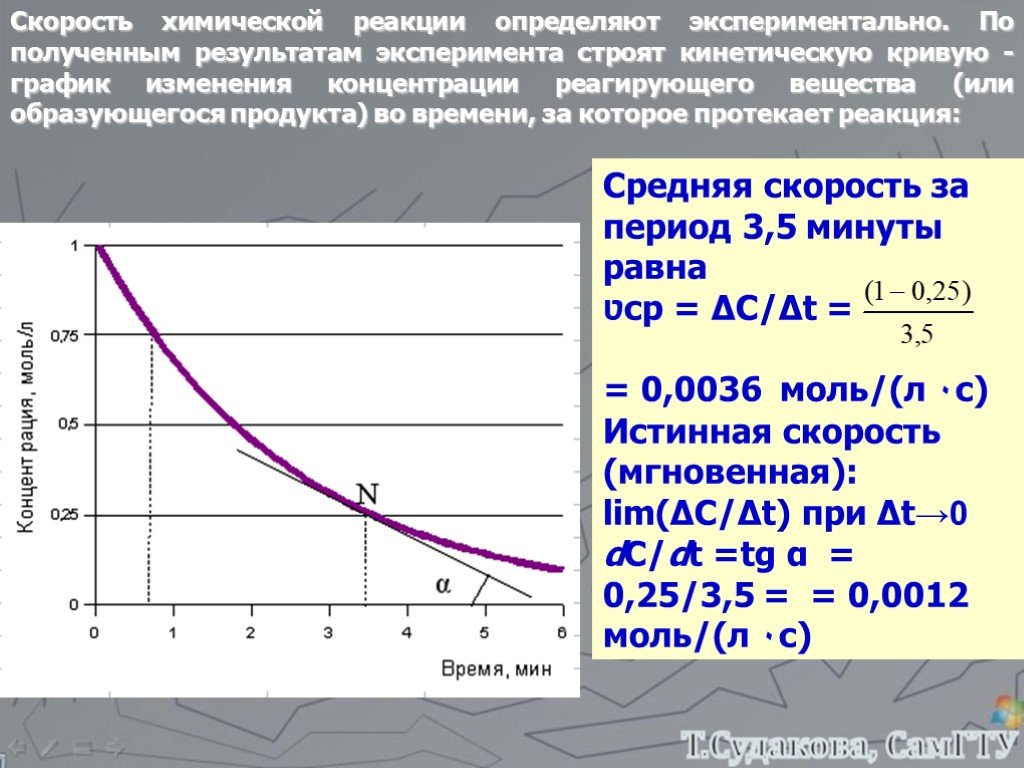
Определение:. Скорость химической реакции – это изменение количества реагирующего вещества в единицу времени в единице объёма. r – скорость химической ...Путешествие по Периодической системе химических элементов
Загадки Ребусы Шарады. Он и легок и пластичен, С блеском серебристым, Но снаружи никогда не бывает чистым. Мы найдем его на кухне, И на стройке, и ..."Соединения химических элементов"
Цель урока. обобщить и систематизировать знания по теме «Соединения химических элементов», подготовиться к контрольной работе. Конкурс 1 «Найди родственников». ...Формулы химических реакций
Закон сохранения массы веществ. Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате этой реакции. М. В. ...Типы химических реакций
Эти явления знаете вы В природе и в нашем быту встречаются они, А отличают эти явления – взаимные превращения, Образуются всегда – новые вещества. ...Атомы химических элементов. Структура Периодической системы
Цель урока:. Цель урока: Обобщение знаний о строении атома, изотопах, формирование понятия «химический элемент», закрепление знаний о структуре Периодической ...Атомы химических элементов
Задание 1: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов ...Cкорость химических реакций
Определение:. Скорость химической реакции – это изменение количества реагирующего вещества в единицу времени в единице объёма. r – скорость химической ...«Систематизация и обобщение знаний по теме «Типы химических реакций»»
1) Что называют химической реакцией? 2) По каким признакам можно утверждать, что произошла или происходит химическая реакция? 3) Какие условия необходимы ..."Типы химических реакций
ЦЕЛЬ УРОКА:. ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ НАВЫКИ СОСТАВЛЕНИЯ ХИМИЧЕСКИХ ..."Тепловой эффект химических реакций
Явления природы Физические Химические. Химические явления – химические реакции. Химическая реакция – процесс превращения одних веществ в другие. 2Н2 ...Сущность химических реакций и признаки их протекания. Тепловой эффект реакции
Верные и неверные утверждения:. Горение ацетона – это физическое явление. Замерзание воды – это химическое явление. Диффузия паров духов – это физическое ...Типы химических реакций
Цель урока: повторить классификацию веществ, типы химических реакций и признак их классификации, научить учащихся применять полученные знания о типах ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...Типы химических реакций на примере свойств воды
Вода Сложное вещество, состоящее из двух химических элементов. Является оксидом. Молекулярная формула воды Формула воды - Н2О В молекуле воды: 2 атома ...В мире химических реакций
Классификация химических реакций по числу и составу реагирующих веществ реакции. « …Мы отнюдь не властвуем над природой, все наше господство состоит ...Химическое равновесие
1.В пробирку №1 и №2 поместили оксид меди. В каждую добавили серной кислоты. Пробирку №2 нагрели. Объясните, как идет реакция в обоих пробирках? CuO+H2SO4=CuSO4 ...Конспекты
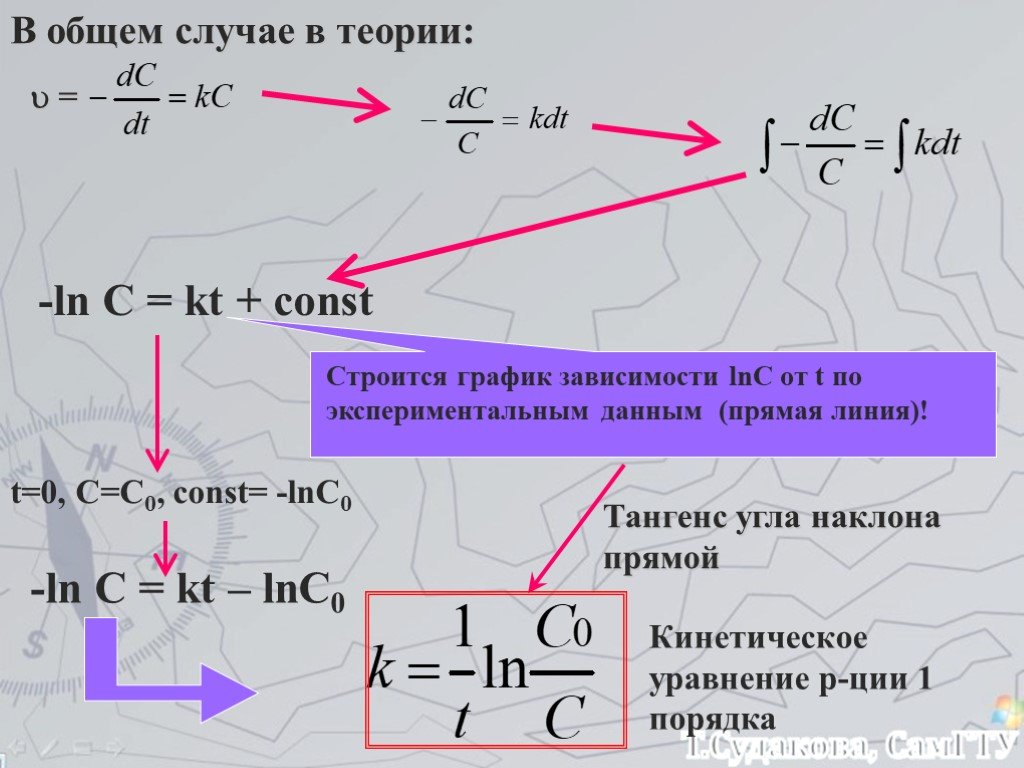
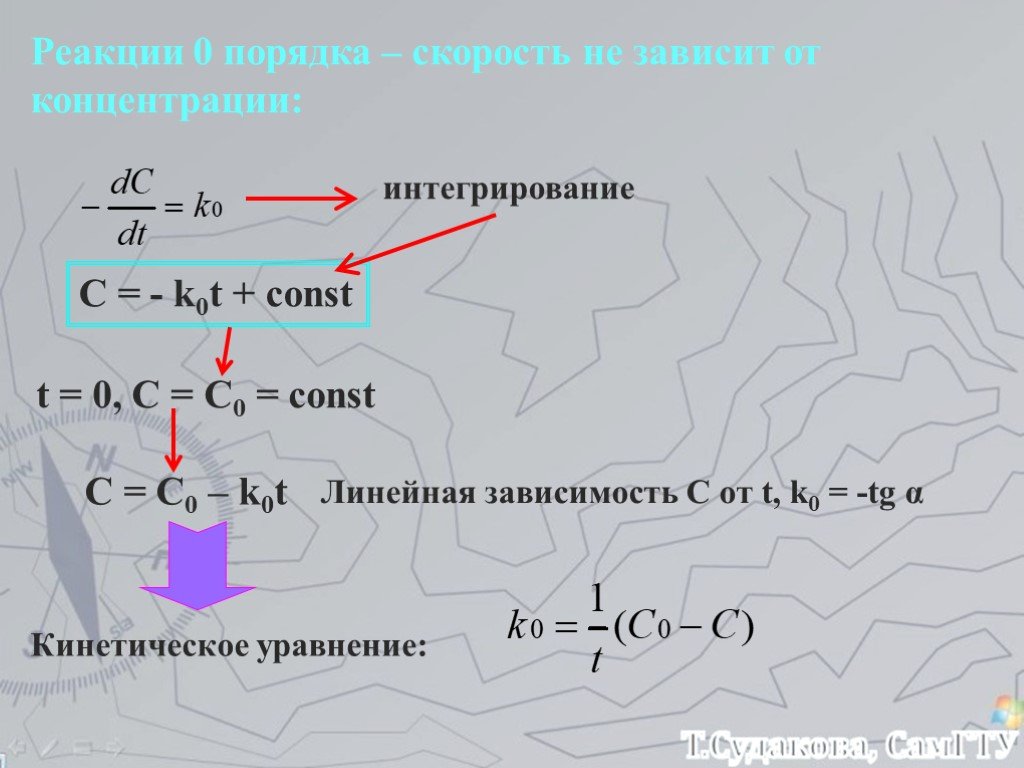
Скорость химических реакций. Химическое равновесие
Обобщение знаний по теме «Скорость химических реакций. Химическое равновесие». Цель:. Обобщение теоретических знаний учащихся о скорости химической ...Типы химических реакций на примере свойств воды
Конспект урока. . по химии на тему. «Типы химических реакций. на примере свойств воды». Подготовила:. Сметанина Ирина Валерьевна. ...Типы химических реакций
. Тема:. . «Типы химических реакций». Класс:. . 8. Форма проведения урока:. . . индивидуально-групповая. . форма работы. ...Составление химических формул по валентности
Муниципальное казённое общеобразовательное учреждение «Тальменская средняя общеобразовательная школа №1». Тальменского района Алтайского края. ...Соединения химических элементов
Автор: Деревенчук Лариса Викторовна. 8 класс. Тема урока: Соединения химических элементов. Тип урока:. урок обобщения и систематизации знаний. ...Скорость химических реакций. Факторы, влияющие на скорость реакций
Скорость химических реакций. Факторы, влияющие на скорость реакций. 9 класс. Урок-исследование. Деятельностная цель:. освоение методов исследовательской ...Электроотрицательность химических элементов
Урок. Электроотрицательность химических элементов. Цель урока. : сформировать представление об электроотрицательности. . . ЗАДАЧИ УРОКА:. . ...Факторы, влияющие на скорость химических реакций
МОУ Судиславская средняя общеобразовательная школа Судиславского муниципального района Костромской области, учитель химии Кабанова Н.Н. . Урок химии ...Закрепление первоначальных химических понятий
Конспект открытого урока по химии. «. Закрепление п. ервоначальных. . химических понятий. в 8 классе». Учитель ...Виды химических связей. Типы кристаллических решеток. П.р. Изготовление моделей молекул
План учебного занятия № 5. Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. Виды химических связей. Типы ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 января 2019
Категория:Химия
Содержит:28 слайд(ов)
Поделись с друзьями:
Скачать презентацию









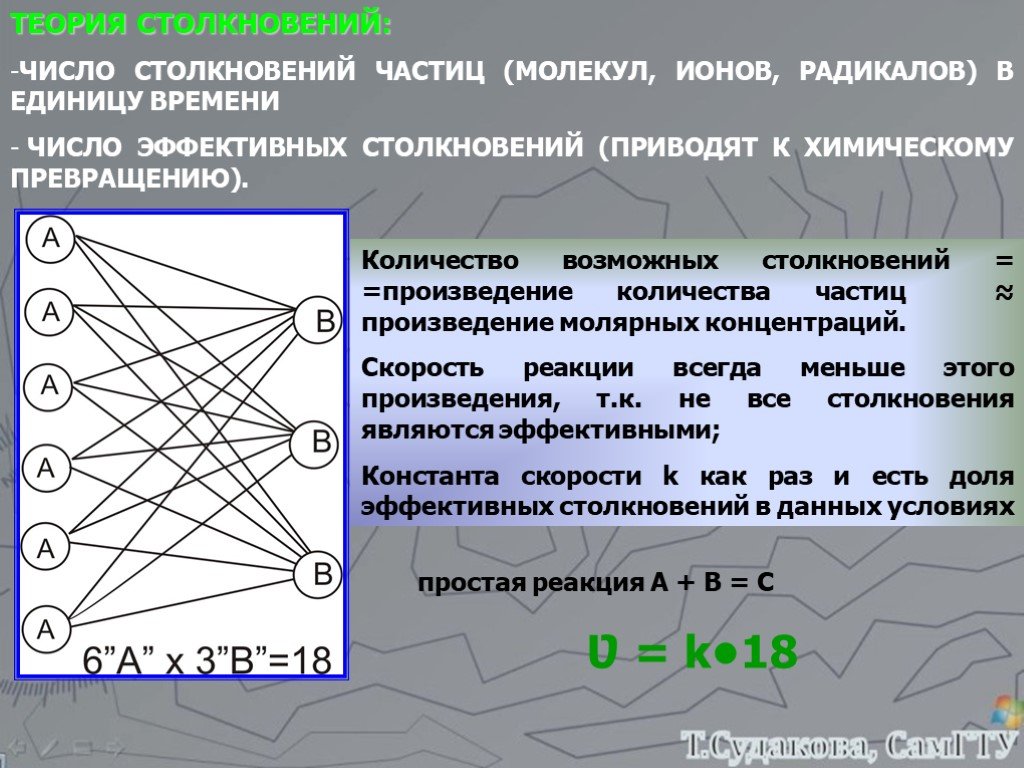

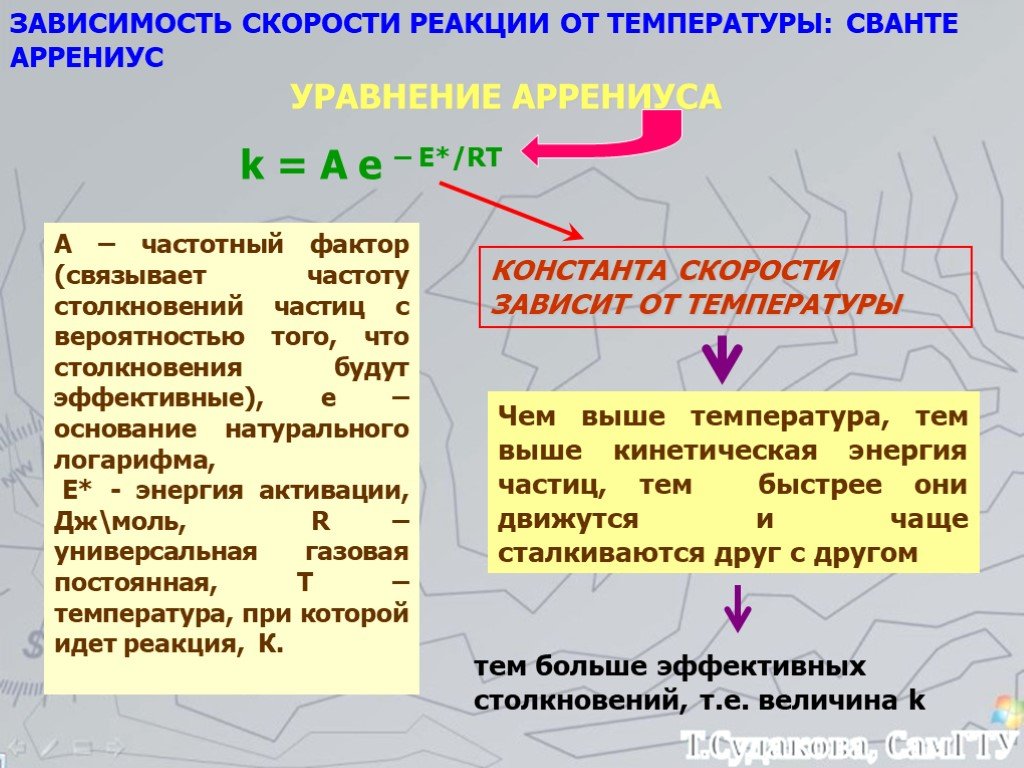
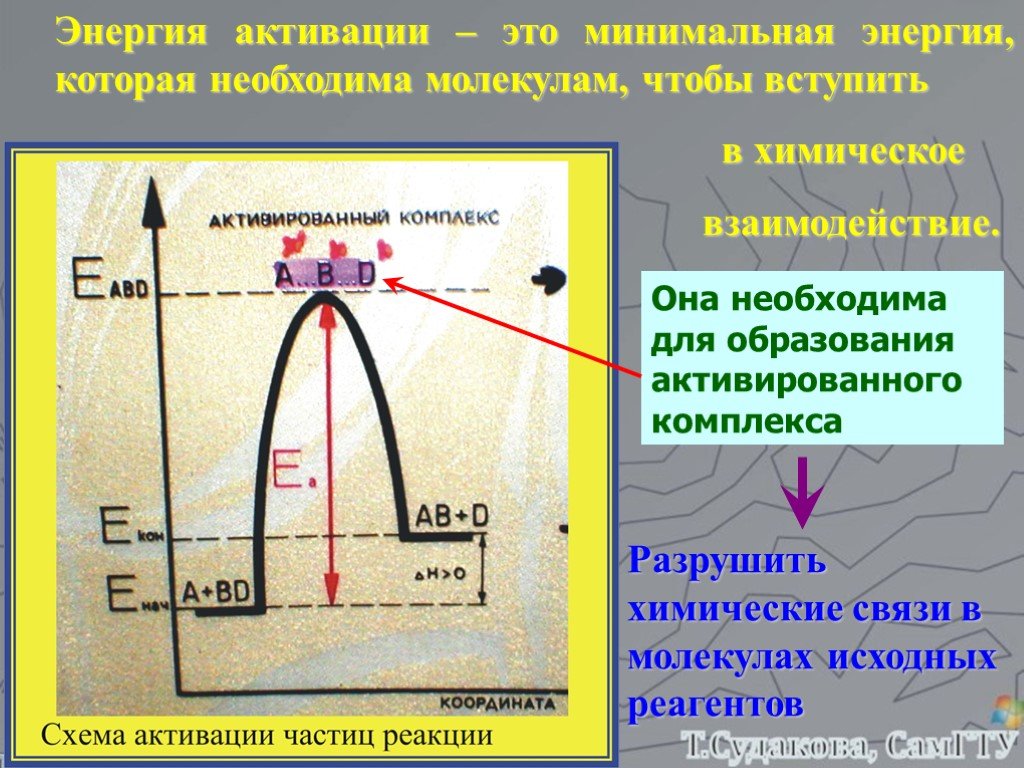

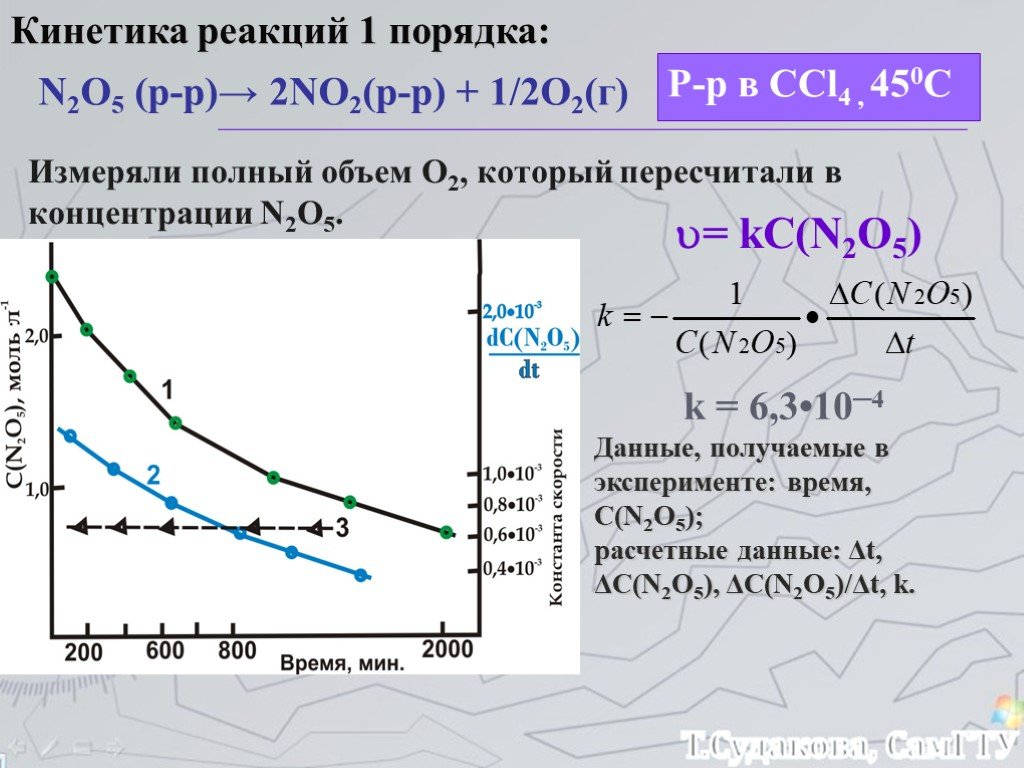

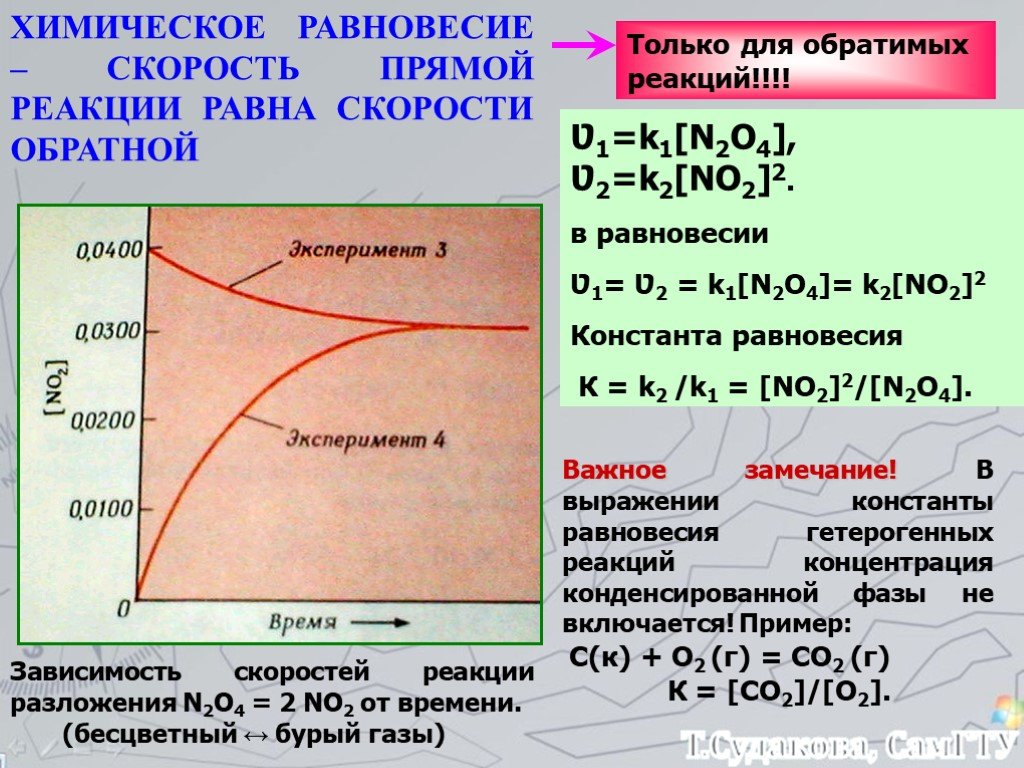

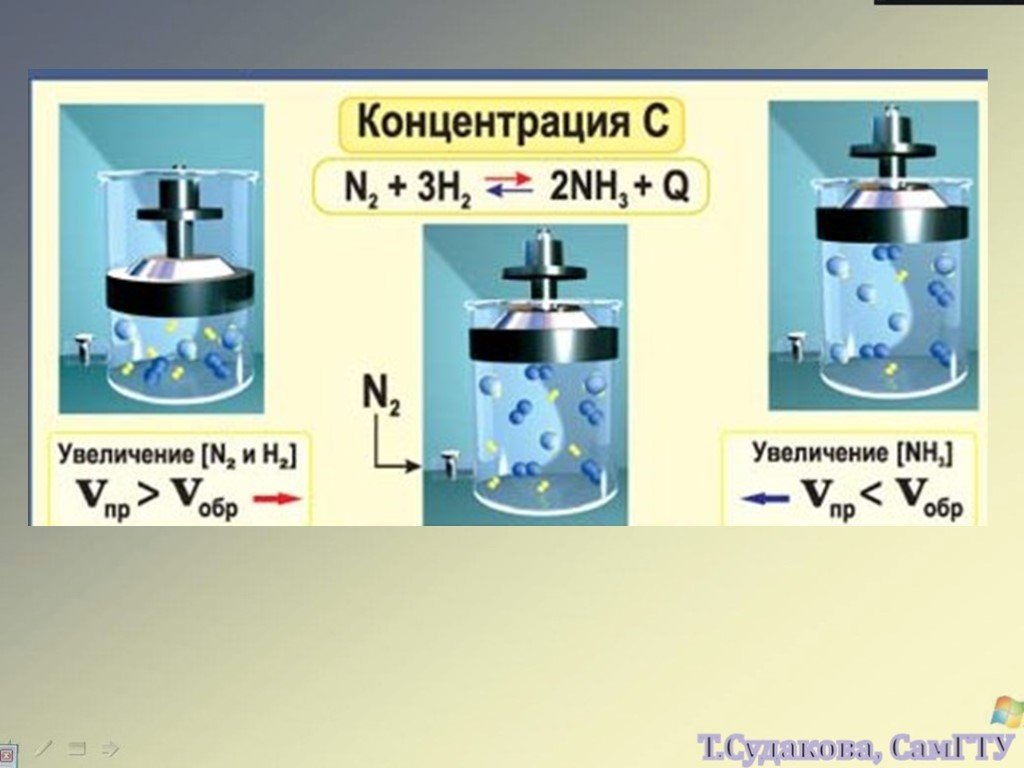
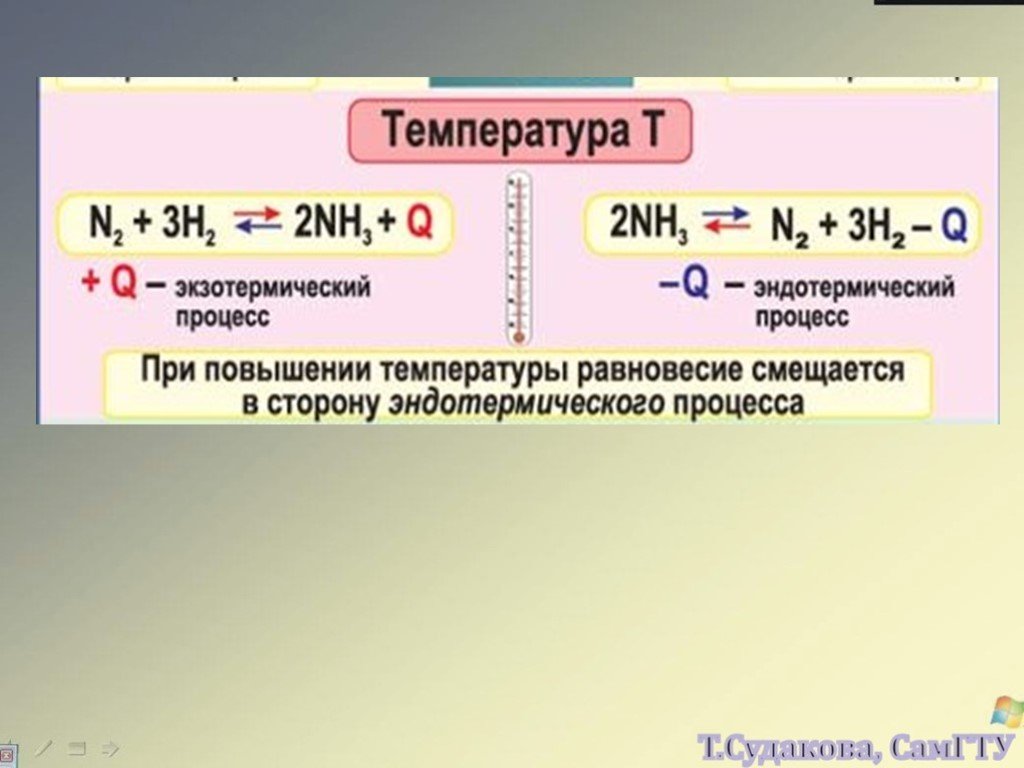
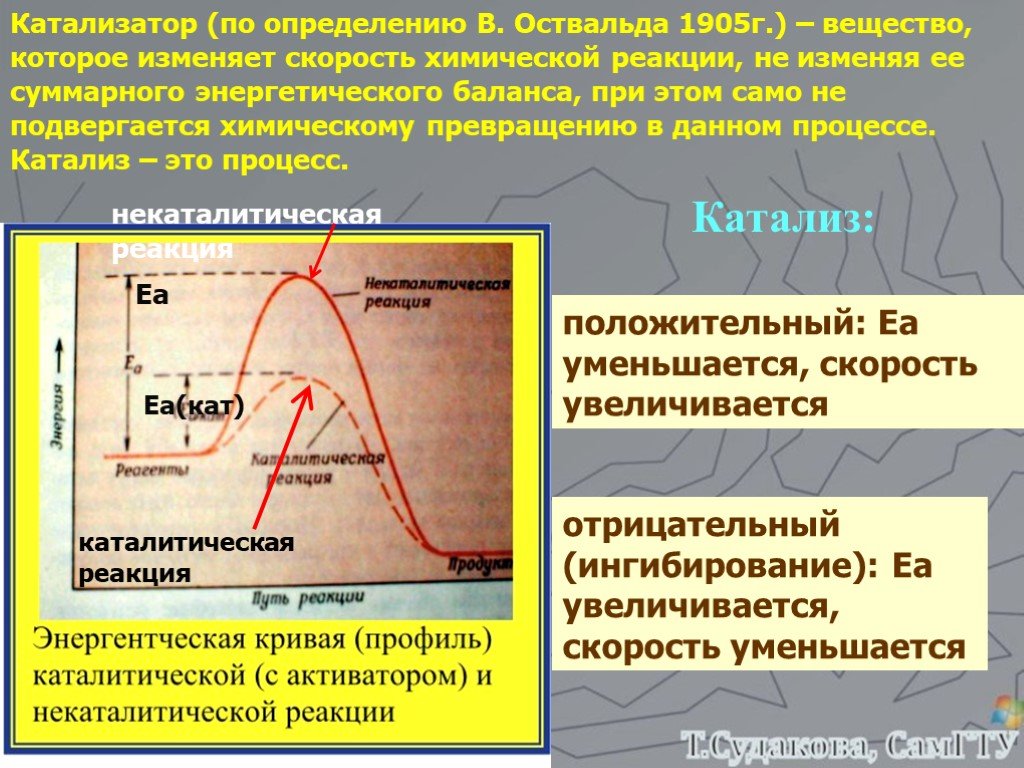
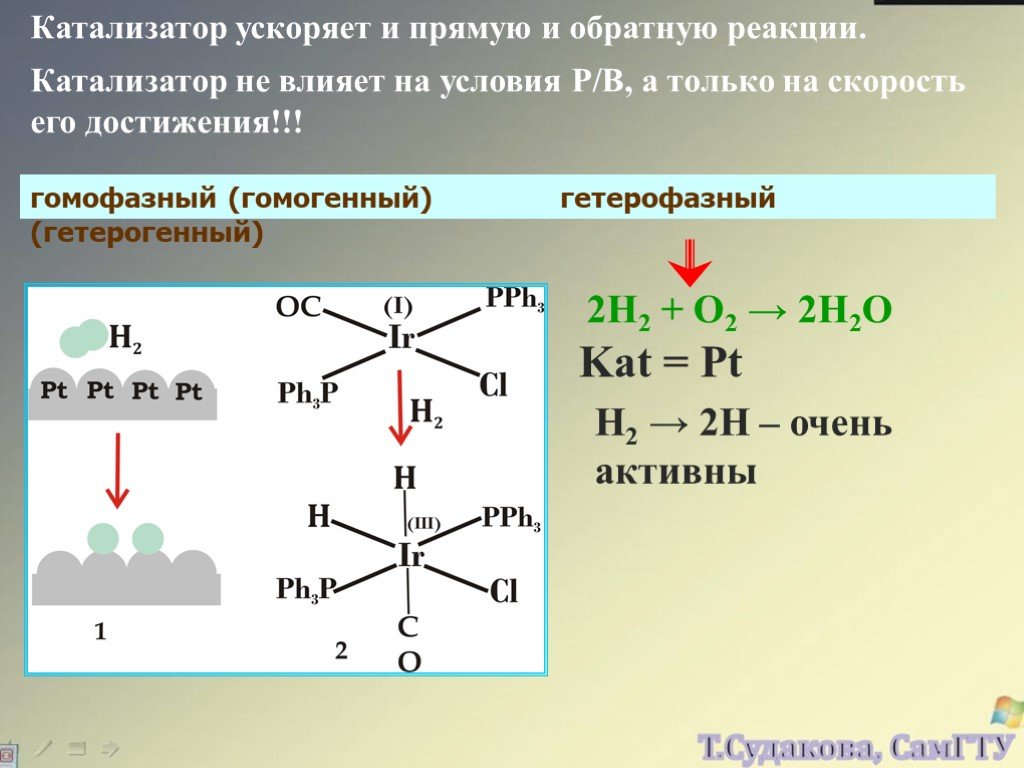
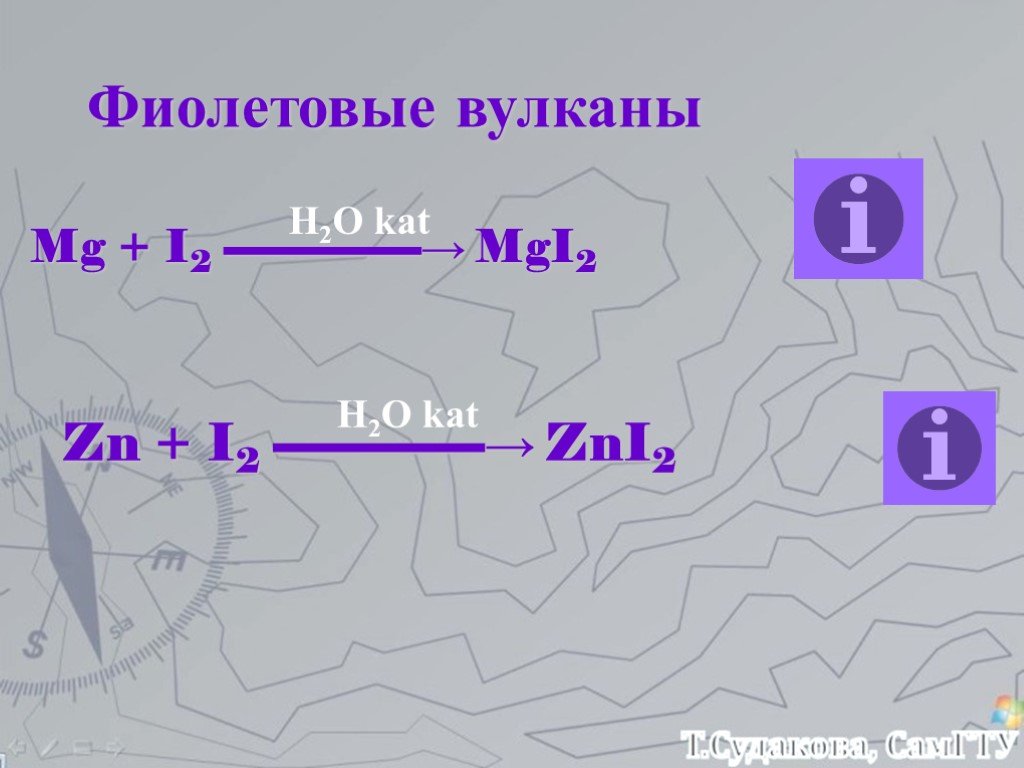

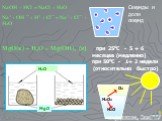
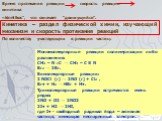












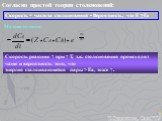

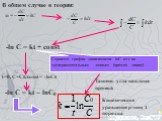
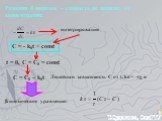

![Зависимость скоростей реакции разложения N2О4 = 2 NО2 от времени. (бесцветный ↔ бурый газы). ХИМИЧЕСКОЕ РАВНОВЕСИЕ – СКОРОСТЬ ПРЯМОЙ РЕАКЦИИ РАВНА СКОРОСТИ ОБРАТНОЙ. Только для обратимых реакций!!!! Ʋ1=k1[N2О4], Ʋ2=k2[NО2]2. в равновесии Ʋ1= Ʋ2 = k1[N2О4]= k2[NО2]2 Константа равновесия К = k2 /k1 = Зависимость скоростей реакции разложения N2О4 = 2 NО2 от времени. (бесцветный ↔ бурый газы). ХИМИЧЕСКОЕ РАВНОВЕСИЕ – СКОРОСТЬ ПРЯМОЙ РЕАКЦИИ РАВНА СКОРОСТИ ОБРАТНОЙ. Только для обратимых реакций!!!! Ʋ1=k1[N2О4], Ʋ2=k2[NО2]2. в равновесии Ʋ1= Ʋ2 = k1[N2О4]= k2[NО2]2 Константа равновесия К = k2 /k1 =](https://prezentacii.org/upload/cloud/19/01/119667/images/thumbs/screen21.jpg)