Презентация "Планетарная модель атома" по физике – проект, доклад
Презентацию на тему "Планетарная модель атома" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
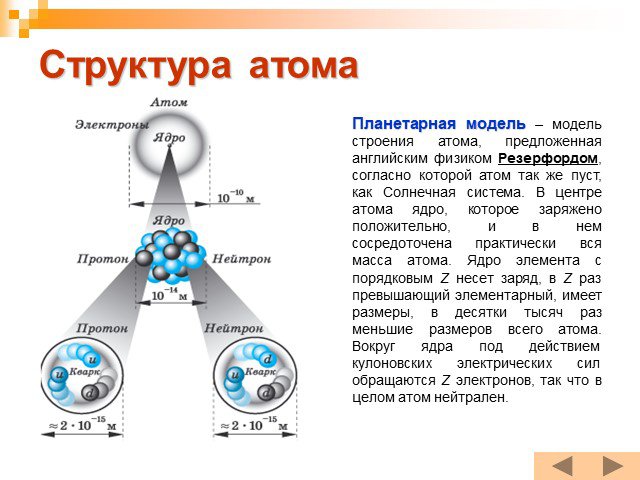
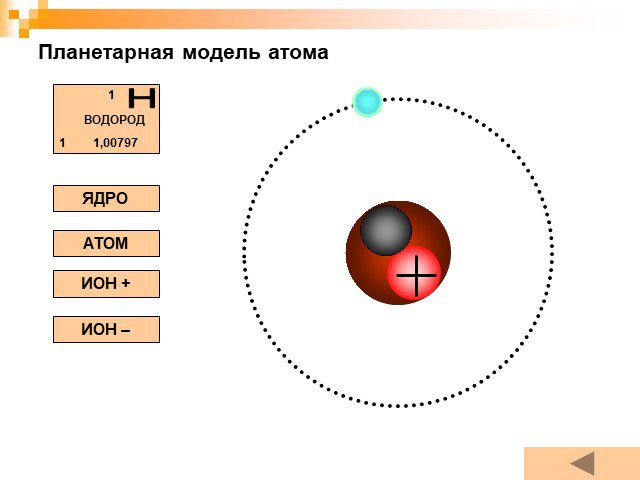
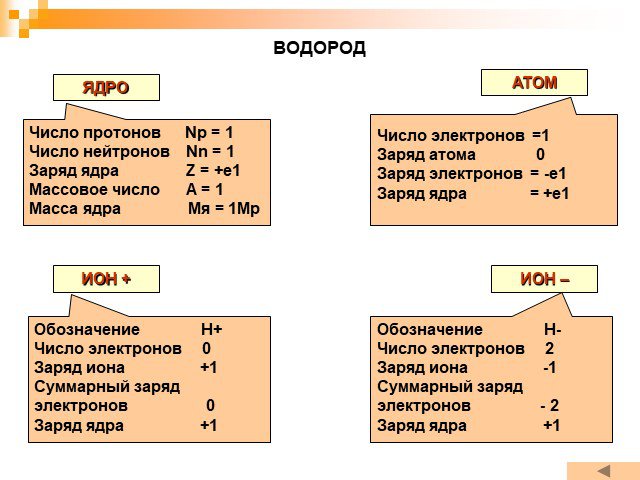
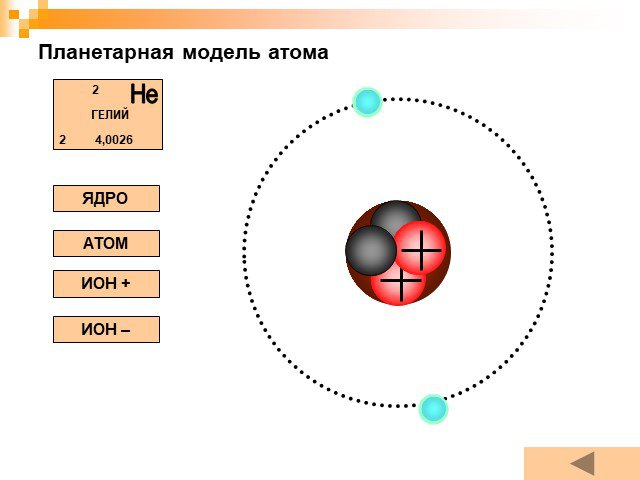
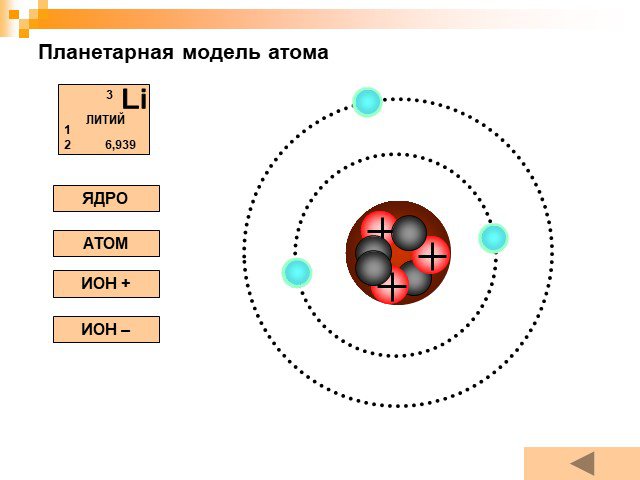
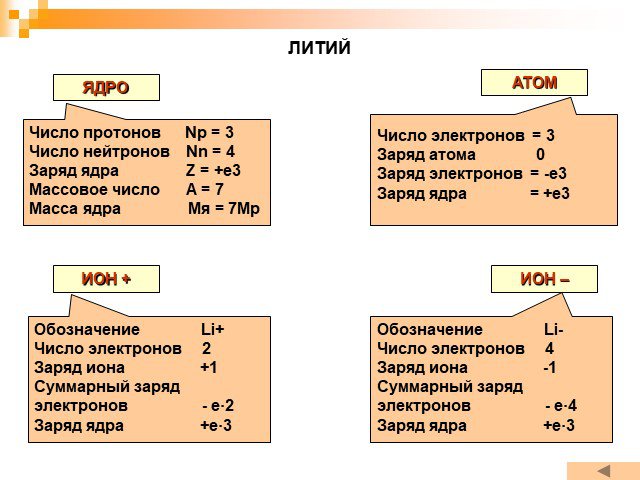
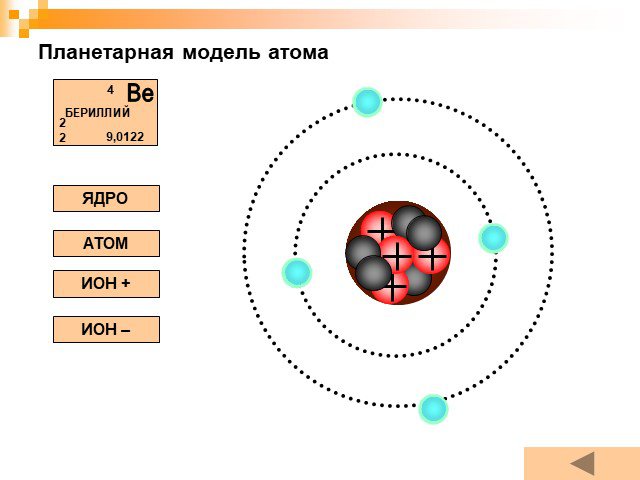
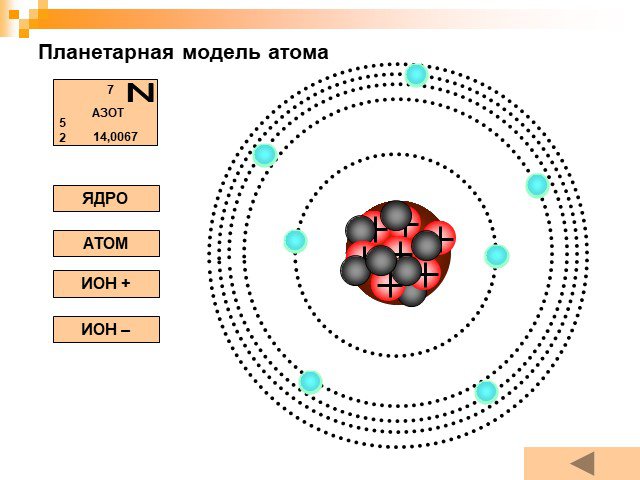
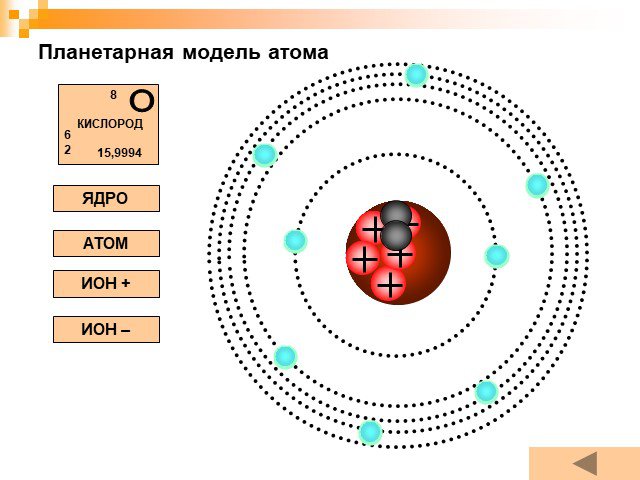
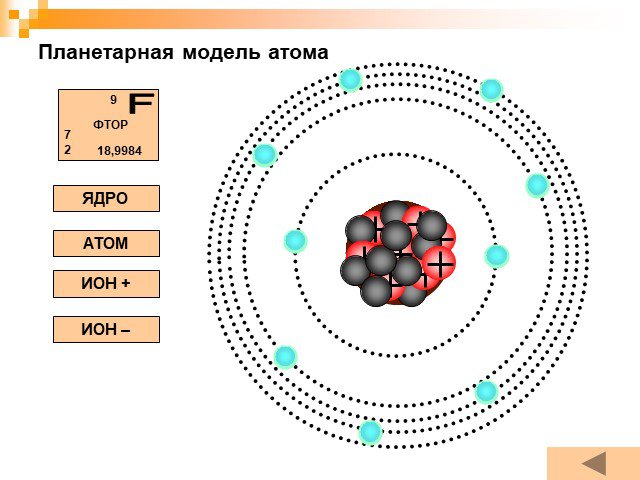
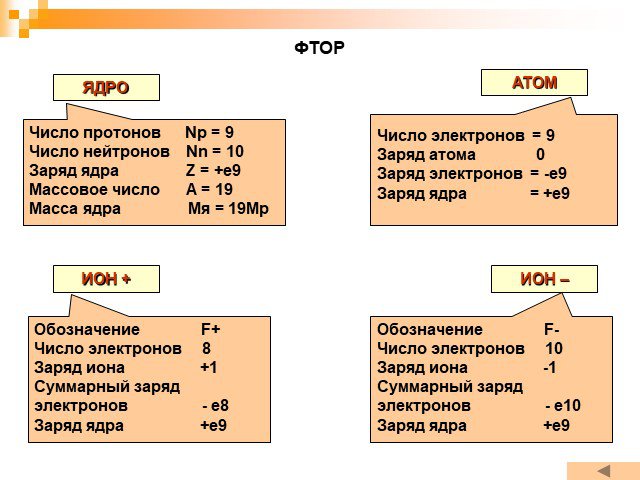
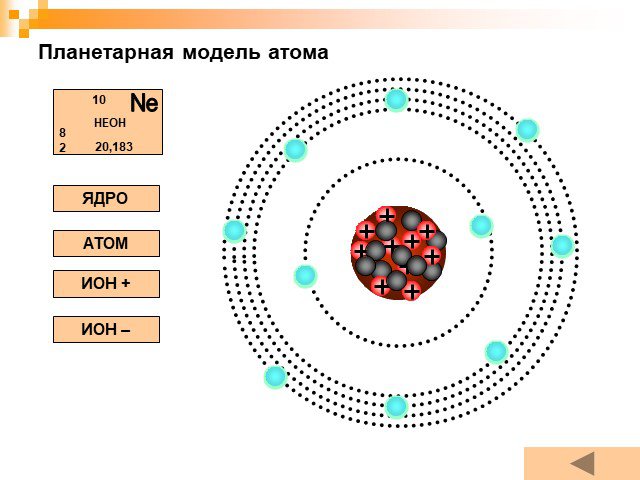
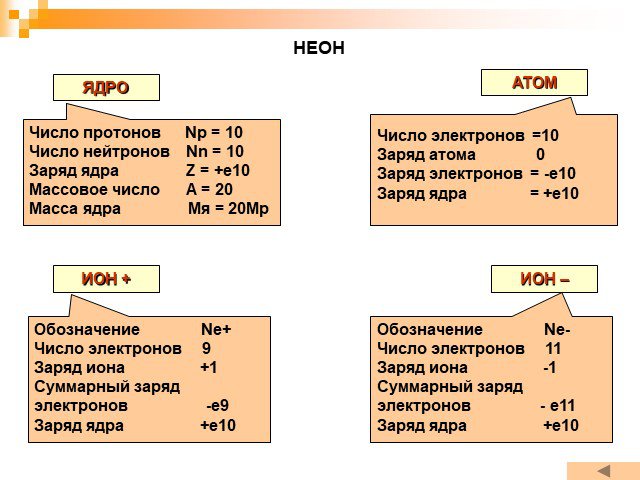
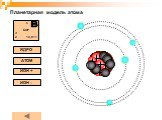
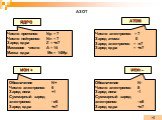
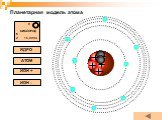
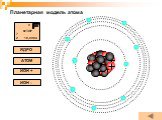
Планетарная модель атома
Модели атомов, созданные до 1910 года были умозрительными, их справедливость нужно было подтвердить или опровергнуть с помощью эксперимента. Решающий ...Планетарная модель атома
Д.Д. Томсон 1856 — 1940 гг. ЭЛЕКТРОН. ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННОЕ ОБЛАКО. «ПУДИНГ С ИЗЮМОМ». ЦЕЛЬ ОПЫТА: проверить, является ли правильной модель Томсона. ...Эрнест Резерфорд. Планетарная модель атома
«Безразлично, с чего начинать рассказ о трудах и днях великого человека. Большая и цельная жизнь как глобус: острова и материки, в каком бы отдаленье ...Модель атома
Тема 7. Модели атомов. Атом водорода по теории Бора. 7.1. Закономерности в атомных спектрах. 7.2. Ядерная модель атомов. 7.3. Элементарная теория ...Модель атома Резерфорда
В 1903 году английским ученым Томсоном была предложена модель атома, которую в шутку назвали «булочкой с изюмом». По его версии атом представляет ...Ядерная модель атома.Квантовые постулаты Бора
Перечень материалов, представленных в методической разработке:. Титульный лист- слайд №1. Перечень материалов, представленных в методической разработке ..."Постулаты Бора. Модель атома водорода по Бору." Презентация: Атомная физика: Постулаты Бора. Модель атома водорода по Бору.
Постулаты Бора Нильс Бор 1885-1962. Первый постулат Бора: атомная система может находится только в особых стационарных, или квантовых, состояниях, ...Строение атома опыт Резерфорда
Ученые древности о строении вещества. Древнегреческий ученый Демокрит 2500 лет назад считал, что любое вещество состоит из мельчайших частиц, которые ...Строение атома элемента
Строение атома. Кто открыл явление радиоактивности? Кто ввел в физику термин «радиоактивность»? Какой химический элемент стал первым известным радиоактивным ...Механическая модель движения альфа-частиц в опыте Резерфорда
Условия опыта Резерфорда:. ОПЫТ РЕЗЕРФОРДА. 1 – радиоактивное вещество, 2 – свинцовая диафрагма, 3 – мишень, 4 – лиминесцирующий экран, 5 – микроскоп. ...Открытия, разрушившие представление о неделимости атома
...Факты, не объяснимые существующими теориями, наиболее дороги для науки, от их разработки следует по преимуществу ожидать ее развития в ближайшем ...Физика атома и атомного ядра
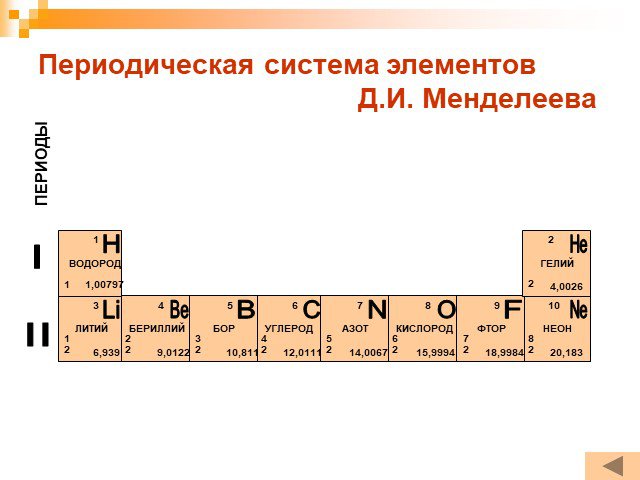
А -18. 1.На рисунке представлен фрагмент Периодической системы элементов Д. И. Менделеева. Под названием элемента приведены массовые числа его основных ...Электронное строение атома
Порядок заполнения орбиталей электронами. VII – 7s5f6d7p 32 VI – 6s4f5d6p 32 V – 5s4d5p 18 IV – 4s3d4p 18 III – 3s3p 8 II – 2s2p 8 I – 1s 2. Е. p+ ...Строение атома
Английский физик Джозеф Джон Томсон (1856-1940). Лауреат Нобелевской Премии 1906 года. Английский физик Эрнст Резерфорд (1871 – 1937). Лауреат Нобелевской ...Физика атома
Тема : «Физика атома». Поурочное планирование. Строение атома по Томсону и Резерфорду. Опыт Резерфорда Постулаты Бора. Атомные спектры Атом водорода. ...Радиоактивность как свидетельство сложного строения атома
Исторические сведения. 22 декабря 1895 год: Рентген В.К. (немецкий ученый) поведал миру об икс-лучах (русские физики назвали их икс лучами) Французский ...Состав ядра атома
План урока:. Вопросы для повторения. Изучение нового материала. Задачи и вопросы для закрепления пройденного материала. Вопросы для повторения. Что ...Радиоактивность . Строение атома
Левкипп Демокрит. Атом – «неделимый». 2500 лет назад. 1896 г. – открытие радиоактивного излучения «Лучи Беккереля». Анри Беккерель (1852-1908). Особые ...Модели атома
Проверка домашнего материала:. Как назвали способность атомов некоторых химических элементов к самопроизвольному излучению? Как были названы частицы, ...Модели строения атома
Цели и задачи. Познакомить учащихся с моделями строения атома; Выяснить принципиальные отличия в строении этих моделей; Показать с помощью экспериментальных ...Конспекты
Строение атома: планетарная модель и модель Бора. Квантовые постулаты Бора. Принцип действия и использование лазера. Экспериментальные методы регистрации заряженных частиц
Урок № 59-169 Строение атома: планетарная модель и модель Бора. Квантовые постулаты Бора. Принцип действия и использование лазера. Экспериментальные ...Модель строения атома
Муниципальное образовательное учреждение. средняя общеобразовательная школа №11. Выксунского района Нижегородской области. Конспект ...Строение атома и атомного ядра
9 класс. . Урок № 8 в теме « Строение атома и атомного ядра». Ядерные силы, ядерные реакции. Энергия связи. Дефект масс. Цели урока : ...Строение атома
Тема. «Строение атома». . 8 класс. Цели для ученика:. Общая цель. :. совершенствовать. знания об электрических явлениях. Образовательные задачи. ...Строение атома
Муниципальное бюджетное общеобразовательное учреждение. «Авнюгская средняя общеобразовательная школа». Верхнетоемского района Архангельской области. ...Ренессанс «мирного атома
Повторительно - обощающий урок по теме:. «Ренессанс «мирного атома» или его закат?». (11 класс). “Знание становится живым, если оно применяетсядля ...Путешествие в мир атома
Клюшина Ж.В.,. . учитель физики МБОУ СОШ №37. . г. Шахты Ростовской области. Тема урока: «Путешествие в мир атома». Цели урока:. Образовательные:. ...Основные сведения о строении атома
Конспект урока с применением ЛСМ (логико-смысловой модели). Тема «Основные сведения о строении атома». . 11 класс (базовый уровень). Цель: ...Атомное ядро. Нуклонная модель ядра
Предмет:. физика. Класс:. 11. Урок №. 63. Дата: _________. Тема урока:. Атомное ядро. Нуклонная модель ядра. Приветствие. Создание положительной ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Физика
Автор презентации:Миляева Оксана Ивановна
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию