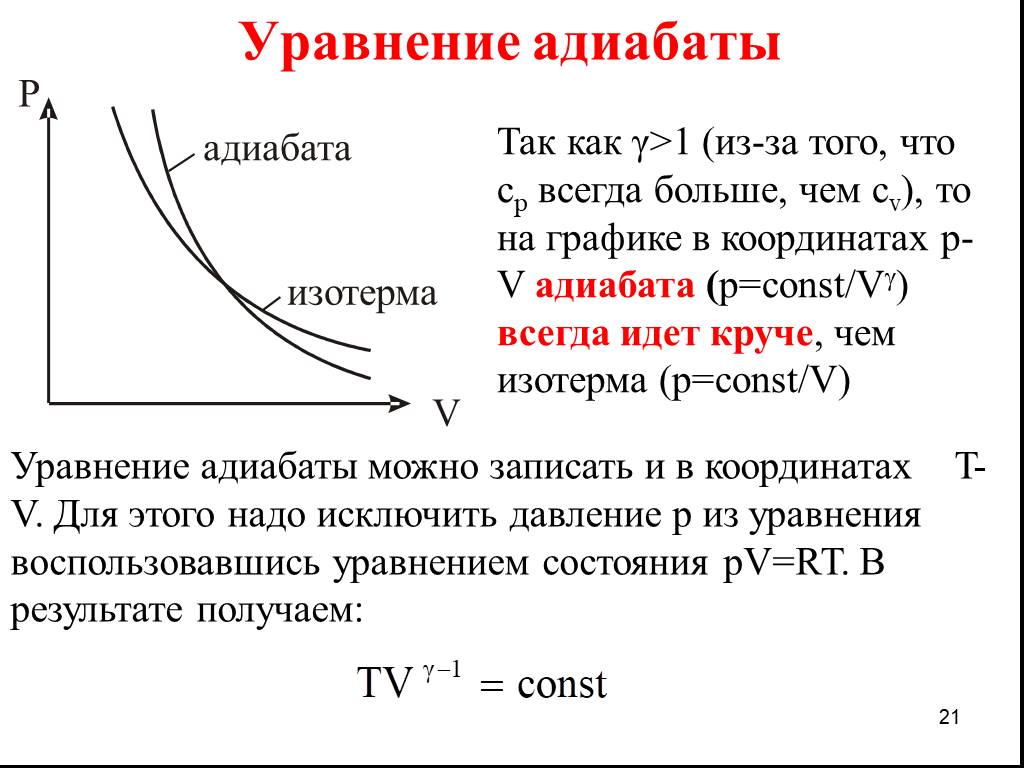
Презентация "13 1-е начало термодинамики, теплоемкость, работа" по физике – проект, доклад
Презентацию на тему "13 1-е начало термодинамики, теплоемкость, работа" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Первое начало термодинамики
Вечный двигатель - воображаемое устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов. Одна из древнейших ...Первое применение начало термодинамики к экзопроцэссам
Изохорный процесс. Диаграмма этого процесса (изохора) в координатах изображается прямой, параллельной оси ординат (см. рис.), где процесс 2-1 есть ...Второе начало термодинамики
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы ...14 2-е начало термодинамики
Изменение внутренней энергии рабочего тела за цикл равно нулю потому, что тело возвращается в исходное состояние. Следовательно, вся полученная теплота ...Основы термодинамики
Цели урока:. Сформировать основные понятия термодинамики Сформулировать первый закон термодинамики Рассмотреть принцип действия тепловых двигателей ...Удельная теплоемкость
Удельная теплоемкость вещества показывает, какое количество теплоты необходимо, чтобы изменить температуру вещества массой 1 кг на 1°С. [c] =. У разных ...Самостоятельная работа
Вопрос 1. 1 вариант Два автомобиля движутся в одном и том же направлении со скоростями υ1 и υ2 относительно поверхности Земли. Чему равна скорость ...Потенциал, работа сил электростатического поля
Тема 3. ПОТЕНЦИАЛ И РАБОТА ЭЛЕКТРОСТАТИЧЕСКОГО ПОЛЯ. СВЯЗЬ НАПРЯЖЕННОСТИ С ПОТЕНЦИАЛОМ. 3.1. Теорема о циркуляции вектора 3.2. Работа сил электростатического ...Астрономические олимпиады, подготовка школьников и работа жюри
Структура олимпиады. Школьный этап. Школьный этап Олимпиады проводится организатором данного этапа Олимпиады (образовательной организацией) в октябре. ...Основы термодинамики Решение задач
Цели урока:. Повторить основные формулы. Научиться применять полученные знания для решения задач. Провести анализ полученных результатов. Основные ...Законы термодинамики
Первый закон термодинамики постулирует существование внутренней энергии – некоторой функции состояния[1] , такой, что если к системе подводится тепло ...Второй закон термодинамики
1. Два положения второго закона термодинамики. Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, ...Второй закон термодинамики
Цель занятия: знать второй закон термодинамики, принцип работы теплового двигателя. Уметь приводить примеры тепловых двигателей и определять КПД. ...Второй закон термодинамики
Обратимый процесс. Это процесс, который может происходить как в прямом, так и в обратном направлении Обратимый процесс – это идеализация реального ...Второй закон термодинамики
Энергия и энтропия являются неотъемлемыми свойствами материи, причем энергия есть мера движения материи, а энтропия – мера рассеивания (деградации) ...Внеклассная работа по физике "Покорители космоса"
Цель:. развитие творческого мышления обучаемых, повышение уровня и качества их знаний, расширить кругозор учащихся, познакомить уч-ся с жизнью и деятельностью ...Основы термодинамики
Основы термодинамики Раздел физики, название которого происходит от греческих слов "терме" - "теплота" и "динамис" - "сила". Изучает он превращение ...Первый закон термодинамики
Первый закон термодинамики. 1. Закон сохранения энергии а) формулировка закона сохранения б) историческая справка 2. Первый закон термодинамики 3. ...Основы термодинамики
Во всем мне хочется дойти До самой сути. В работе, в поисках пути, В сердечной смуте. « Основы термодинамики». Игра № 1. (Вопросы до 2 баллов.) 1. ...Первый закон термодинамики
Цель презентации:. Применить физический закон к различным процессам на основе имеющихся знаний; Работать над формированием сравнивать явления, делать ...Конспекты
Первое начало термодинамики
. Урок разработала:. Свириденко Ольга Владимировна – учитель физики МОУ «СОШ р.п. Красный Текстильщик Саратовского района Саратовской области». ...Удельная теплоемкость
Урок по теме: «Удельная теплоемкость». Д.з.: §9 ? после §9 (устно). . Упр. 5(1,2) – письменно, стр.25. 1.Проверка усвоения домашнего задания. ...Первый закон термодинамики
Урок по теме «Первый закон термодинамики». 10 класс. Цели урока:. . образовательные:. ввести первый закон термодинамики как закон сохранения ...Механическая работа
. Тема. «Механическая работа». . 7 класс. . . Номер урока. (в году/ в теме) - 51/1. Цель:. на уроке обучающиеся познакомятся с работой как ...Механическая работа
. Тема: Механическая работа. . . Цель урока:. познакомиться с работой как новой физической; вывести формулу для ее расчета; определить единицу ...Механическая работа
Муниципальное бюджетное общеобразовательное учреждение. «Качульская средняя общеобразовательная школа». Каратузского района Красноярского края. ...Механическая работа
Технологическая карта урока. Предмет. : естествознание. Класс. : 6 «Б» класс. Тема урока:. . «. Механическая работа. ». Тип урока. : открытие ...Исследование первого закона термодинамики к различным изопроцессам
Открытый урок по физике в 10 классе. Тема урока. «Исследование первого закона термодинамики к различным изопроцессам». Тип урока –. интегрированный, ...Законы термодинамики
Урок рок физики по теме " Законы термодинамики". . Познавательные цели и задачи урока. Повторить и закрепить понятия: внутренняя энергия, тепловое ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Физика
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию